题目内容
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种离子组成,取溶液进行如下连续实验:
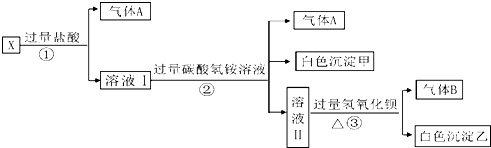
(1)白色沉淀甲是 .X溶液中一定存在的离子是 .
(2)白色沉淀乙中一定有: ,可能有 证明其是否存在的方法是 .
(3)将过量的气体A与适量的气体B通入水中,写出反应的离子方程式 .

(1)白色沉淀甲是
(2)白色沉淀乙中一定有:
(3)将过量的气体A与适量的气体B通入水中,写出反应的离子方程式
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:溶液为无色,可知不存在高锰酸根离子,加入盐酸生成气体,可知一定含有碳酸根离子,排除银离子、钡离子、铝离子,溶液呈电中性,所以一定含有阳离子钠离子,溶液I加入过量碳酸氢铵反应生成二氧化碳,白色沉淀甲是偏铝酸根离子和过量盐酸反应生成的铝离子与碳酸根或碳酸氢根水解生成的氢氧化铝沉淀,判断原溶液一定含有AlO2-;溶液Ⅱ加入过量氢氧化钡生成气体B为NH3,沉淀乙为碳酸钡沉淀或碳酸钡和硫酸钡沉淀的混合物,据此解答.
解答:
解:(1)溶液为无色,可知不存在高锰酸根离子,加入盐酸生成气体,可知一定含有碳酸根离子,排除银离子、钡离子、铝离子,溶液中含有阳离子,所以一定有钠离子,溶液I加入过量碳酸氢铵反应生成二氧化碳,白色沉淀甲是偏铝酸根离子和过量盐酸反应生成的铝离子与碳酸根或碳酸氢根水解生成的氢氧化铝沉淀,判断原溶液一定含有AlO2-,所以溶液中一定含有的离子为:Na+、AlO2-、CO32-,白色沉淀甲为氢氧化铝;
故答案为:氢氧化铝;Na+、AlO2-、CO32-;
(2)过量的碳酸氢根与氢氧化钡反应一定生成碳酸钡沉淀,溶液X中可能存在的硫酸根离子能够与氢氧化钡反应生成硫酸钡沉淀,检验方法:取少量沉淀放在试管中,加入硝酸,沉淀部分溶解,证明沉淀中含硫酸钡,沉淀全部溶解在,不含硫酸钡沉淀;
故答案为:BaCO3 ;BaSO4;取少量沉淀放在试管中,加入硝酸,沉淀部分溶解,证明沉淀中含硫酸钡,沉淀全部溶解在,不含硫酸钡沉淀;
(3)将过量的气体A为CO2与适量的气体B为NH3通入水中,反应的离子方程式:CO2+NH3+H2O=NH4++HCO3-;
故答案为:CO2+NH3+H2O=NH4++HCO3-.
故答案为:氢氧化铝;Na+、AlO2-、CO32-;
(2)过量的碳酸氢根与氢氧化钡反应一定生成碳酸钡沉淀,溶液X中可能存在的硫酸根离子能够与氢氧化钡反应生成硫酸钡沉淀,检验方法:取少量沉淀放在试管中,加入硝酸,沉淀部分溶解,证明沉淀中含硫酸钡,沉淀全部溶解在,不含硫酸钡沉淀;
故答案为:BaCO3 ;BaSO4;取少量沉淀放在试管中,加入硝酸,沉淀部分溶解,证明沉淀中含硫酸钡,沉淀全部溶解在,不含硫酸钡沉淀;
(3)将过量的气体A为CO2与适量的气体B为NH3通入水中,反应的离子方程式:CO2+NH3+H2O=NH4++HCO3-;
故答案为:CO2+NH3+H2O=NH4++HCO3-.
点评:本题为离子推断题,明确物质的特殊性质及相互转化关系是解题关键,注意盐类的双水解的反应,题目难度中等.

练习册系列答案
相关题目
NA为阿伏伽德罗常数,下列叙述错误的是( )
| A、常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6NA |
| B、1mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
| C、由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA |
| D、6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
下列对物质的分类正确的是( )
| A、盐酸 酸 |
| B、纯碱 碱 |
| C、二氧化硫 酸性氧化物 |
| D、生石灰 盐 |
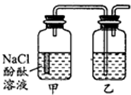 某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )
某课外活动小组,将剪下的一块镀锌铁放入试剂瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞溶液,按图装置进行实验,数分钟后观察,下列现象不可能出现的是( )| A、乙中导气管里形成一段水柱 |
| B、乙中导气管中产生气泡 |
| C、金属片剪口处溶液变红 |
| D、锌被腐蚀 |
久置在空气中不会变质的物质是( )
| A、硫酸亚铁 | B、硫酸钠 |
| C、过氧化钠 | D、漂白粉 |
