题目内容
某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验:
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质.请回答以下问题:
(1)图1操作①的名称是 ;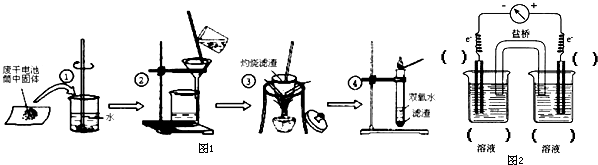
(2)图1操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、泥三角和三脚架;滤渣中存在的物质有 .
(3)黑色固体为 ,图1操作④相关的化学方程式为 .
(4) (填写操作与现象),则证实滤液中含有NH4+.
(5)完成图2实验装置.
正极方程式: .
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质.请回答以下问题:
(1)图1操作①的名称是

(2)图1操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、
(3)黑色固体为
(4)
(5)完成图2实验装置.
正极方程式:
考点:实验装置综合
专题:实验题
分析:(1)固体物质加入水中是物质的溶解过程;
(2)根据对物质进行灼烧过程需要的仪器:酒精灯、玻璃棒、泥三角和三脚架、坩埚来回答,碳单质灼烧会产生二氧化碳;
(3)能使双氧水迅速产生氧气的黑色物质是二氧化锰,双氧水分解生成水和氧气;
(4)铵根离子的检验是用浓氢氧化钠溶液并加热转化为氨气,然后用湿润的红色石蕊试纸检验;
(5)Zn、Cu、硫酸铜溶液可以构成原电池,Zn为负极,Cu为正极,正极上铜离子得电子.
(2)根据对物质进行灼烧过程需要的仪器:酒精灯、玻璃棒、泥三角和三脚架、坩埚来回答,碳单质灼烧会产生二氧化碳;
(3)能使双氧水迅速产生氧气的黑色物质是二氧化锰,双氧水分解生成水和氧气;
(4)铵根离子的检验是用浓氢氧化钠溶液并加热转化为氨气,然后用湿润的红色石蕊试纸检验;
(5)Zn、Cu、硫酸铜溶液可以构成原电池,Zn为负极,Cu为正极,正极上铜离子得电子.
解答:
解:(1)固体物质加入水中是物质的溶解过程,故答案为:溶解;
(2)对物质进行灼烧过程需要的仪器:酒精灯、玻璃棒、泥三角和三脚架、坩埚使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,二氧化碳可由黑色的碳单质灼烧制得,二氧化硫可由淡黄色的硫单质灼烧制得,所以该黑色物质是碳单质.
故答案为:坩埚;碳;
(3)能使带火星的木条复燃的气体是氧气,能使双氧水迅速产生氧气的黑色固体物质是二氧化锰,双氧水分解生成水和氧气,反应的方程式为:2H2O2
2H2O+O2↑;
故答案为:MnO2;2H2O2
2H2O+O2↑;
(4)铵根离子的检验:铵根离子能和强碱在加热条件下反应生成氨气,氨气能使湿润的红色石蕊试纸变蓝色;如果湿润的红色石蕊试纸变蓝色,就说明有铵根离子存在;
故答案为:加入浓氢氧化钠溶液并加热,将润湿红色石蕊试纸置于试管口附近,试纸变蓝色;
(5)Zn、Cu、硫酸铜溶液可以构成原电池,Zn和硫酸锌溶液组成负极,Cu与硫酸铜溶液组成正极,正极上铜离子得电子生成Cu,正极的电极方程式为:Cu2++2e-=Cu,其原电池装置图为: ;
;
故答案为: ;Cu2++2e-=Cu.
;Cu2++2e-=Cu.
(2)对物质进行灼烧过程需要的仪器:酒精灯、玻璃棒、泥三角和三脚架、坩埚使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,二氧化碳可由黑色的碳单质灼烧制得,二氧化硫可由淡黄色的硫单质灼烧制得,所以该黑色物质是碳单质.
故答案为:坩埚;碳;
(3)能使带火星的木条复燃的气体是氧气,能使双氧水迅速产生氧气的黑色固体物质是二氧化锰,双氧水分解生成水和氧气,反应的方程式为:2H2O2
| ||
故答案为:MnO2;2H2O2
| ||
(4)铵根离子的检验:铵根离子能和强碱在加热条件下反应生成氨气,氨气能使湿润的红色石蕊试纸变蓝色;如果湿润的红色石蕊试纸变蓝色,就说明有铵根离子存在;
故答案为:加入浓氢氧化钠溶液并加热,将润湿红色石蕊试纸置于试管口附近,试纸变蓝色;
(5)Zn、Cu、硫酸铜溶液可以构成原电池,Zn和硫酸锌溶液组成负极,Cu与硫酸铜溶液组成正极,正极上铜离子得电子生成Cu,正极的电极方程式为:Cu2++2e-=Cu,其原电池装置图为:
 ;
;故答案为:
 ;Cu2++2e-=Cu.
;Cu2++2e-=Cu.
点评:本题考查了基本实验操作及离子的检验、原电池原理的应用,题目难度中等,熟悉中学阶段常见阴阳离子的检验方法,如氯离子、硫酸根离子、钠离子、钾离子、铵根离子等,注意把握原电池的构成条件.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
将一定量的Na2SO4溶于90ml水中,使得每100个水分子中溶有一个Na+,这一定量的Na2SO4是 (( )
| A、142g |
| B、71g |
| C、0.05mol |
| D、0.025mol |
下列有关水的说法错误的是( )
| A、水是氧化物 |
| B、煮沸可降低自来水的硬度 |
| C、肥皂水可区分硬水和软水 |
| D、电解水的实验,说明水是由氢气和氧气组成的 |
下列说法正确的是( )
| A、在100℃、101 KPa条件下,1mol液态水汽化为水蒸气吸收的热量为40.69KJ,则H2O(g)?H2O(l) 的△H=-40.69KJ/mol |
| B、已知MgCO3的Ksp=6.82×10-4mol2/L2,则所有含固体MgCO3的溶液中,都有C(Mg 2+ )=C(CO32-),且 C(Mg2+)?C(CO32-)=6.82×10-4mol2/L2 |
| C、已知:C-C的键能348KJ/mol,C=C的键能610KJ/mol,C-H的键能413KJ/mol, H-H的键能436KJ/mol, 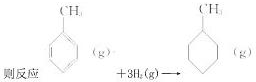 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol |
| D、碳酸氢钠溶液中存在:c(H*)+c(H2CO3)=c(OH-)+c(CO32-) |
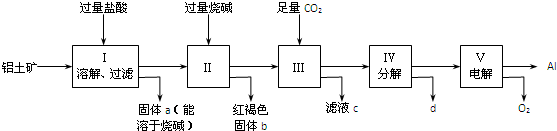
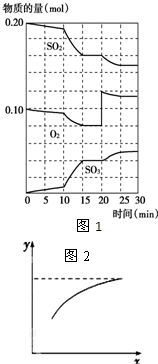 硫酸生产中,接触室内的反应为:
硫酸生产中,接触室内的反应为: