题目内容
10.1898年,居里夫人经过一段漫长、枯燥而又艰苦的工作,终于从数吨沥青铀矿中提炼出一小撮放射性粉末,并分离出了两种放射性元素钋和镭,其中镭是元素周期表中第7周期ⅡA族的元素.下列关于镭的性质描述中不正确的是( )| A. | 在化合物中呈现+2价 | B. | 氢氧化物呈强碱性 | ||
| C. | 单质与冷水不反应 | D. | 碳酸盐难溶于水 |
分析 镭是元素周期表中第7周期ⅡA族的元素,结合同主族从上到下金属性增强及同主族元素及化合物性质相似来解答.
解答 解:A.由ⅡA族可知,在化合物中呈现+2价,故A正确;
B.由氢氧化钙为中强碱可知,金属性镭>钙,则氢氧化镭呈强碱性,故B正确;
C.Ca与水反应,则镭与冷水剧烈反应,故C错误;
D.由碳酸钙、碳酸镁不溶于水可知,碳酸镭难溶于水,故D正确;
故选C.
点评 本题考查元素在周期表的位置及应用,为高频考点,把握原子结构与元素的位置、元素周期律为解答的关键,侧重于学生的分析与应用能力的考查,注意同主族元素化合物性质的相似性和递变性,题目难度不大.

练习册系列答案
相关题目
20.下列说法不正确的是( )
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) | |
| C. | CH3CH3的二溴代烷有2种,则CH3CH3的四溴代烷也是2种 | |
| D. | 用-C3H7取代甲苯苯环上的1个氢原子,所得芳香烃的数目是三种 |
1.制备干燥氨气所需的药品是( )
| A. | NH4Cl溶液、NaOH溶液、浓H2SO4 | B. | 饱和氨水 | ||
| C. | NaOH溶液、NH4Cl晶体、浓H2SO4 | D. | NH4Cl固体、碱石灰、氢氧化钙 |
18.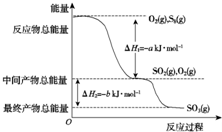 在200℃下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol含硫产物的数据).由图得出的结论正确的是( )
在200℃下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol含硫产物的数据).由图得出的结论正确的是( )
 在200℃下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol含硫产物的数据).由图得出的结论正确的是( )
在200℃下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol含硫产物的数据).由图得出的结论正确的是( )| A. | S8(s)的燃烧热△H=-8a kJ•mol-1 | |
| B. | 2SO3(g)═2SO2(g)+O2(g)△H=-2b kJ•mol-1 | |
| C. | S8(s)+8O2(g)═8SO2(g)△H=-a kJ•mol-1 | |
| D. | 由1 mol S8(s)生成SO2的反应热△H=-(a+b) kJ•mol-1 |
5.亚硫酸盐是一种常见的食品添加剂.用如图实验可检验某食品中亚硫酸盐含量(含量通常以1kg样品中含SO2的质量计;所加试剂均足量),下列说法不正确的是( )
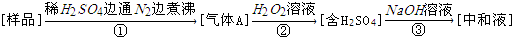
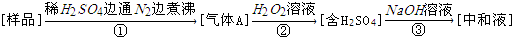
| A. | 亚硫酸盐作为食品添加剂作用是防腐、抗氧化 | |
| B. | 反应①中通入N2的作用是将生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |
15.稀硫酸酸化后的软锰矿(主要成分为MnO2 )悬浊液可用于吸收燃煤尾气中的SO2,得到MnSO4;MnSO4可与KMnO4反应制备电池材料MnO2,同时生成H2SO4.下列用来解释事实的方程式不正确的是( )
| A. | MnO2吸收SO2的反应:MnO2+SO2═MnSO4 | |
| B. | MnO2作为碱性电池正极材料时的放电反应:MnO2+e-+H+═MnOOH | |
| C. | MnSO4与KMnO4反应制备MnO2:2MnO4-+3Mn2++2H2O═5MnO2+4H+ | |
| D. | 尾气中的SO2 还可用足量的氨水吸收:SO2+2NH3•H2O═2NH4++SO32-+H2O |
2.下表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
(1)⑦的最低负价是-2;⑧的最高价含氧酸的化学式为HClO4.
(2)③、④、⑦、⑧的简单离子半径由大到小的顺序为Cl->O2->Mg2+>Al3+.
(3)⑤、⑥的单质中更容易与①的单质反应的是N2.
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(5)⑧、⑨、⑩三种元素形成的氢化物水溶液酸性强弱顺序为:HI>HBr>HCl.
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质.写出该反应的离子方程式2H++H2O2+2I-=2H2O+I2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
(2)③、④、⑦、⑧的简单离子半径由大到小的顺序为Cl->O2->Mg2+>Al3+.
(3)⑤、⑥的单质中更容易与①的单质反应的是N2.
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(5)⑧、⑨、⑩三种元素形成的氢化物水溶液酸性强弱顺序为:HI>HBr>HCl.
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质.写出该反应的离子方程式2H++H2O2+2I-=2H2O+I2.
19.下列解释正确的是( )
| A. | H2O很稳定,是因为水分子之间存在氢键 | |
| B. | HF的熔、沸点在同族元素的氢化物中出现反常,是因为HF分子中有氢键 | |
| C. | 卤素单质从上到下熔沸点升高,是因为它们的组成结构相似,从上到下其摩尔质量增大,分子间的范德华力增大 | |
| D. | 氨气极易溶于水,与氢键没有关系 |
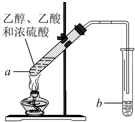 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题.