题目内容
1.制备干燥氨气所需的药品是( )| A. | NH4Cl溶液、NaOH溶液、浓H2SO4 | B. | 饱和氨水 | ||
| C. | NaOH溶液、NH4Cl晶体、浓H2SO4 | D. | NH4Cl固体、碱石灰、氢氧化钙 |
分析 实验室用氯化铵和消石灰反应制备氨气,氨气为碱性气体,易溶于水,不能用溶液制备氨气,干燥氨气应用碱性或中性干燥剂.
解答 解:A.氨气易溶于水,不能用溶液制备氨气,氨气为碱性气体,不能用浓硫酸干燥,故A错误;
B.饱和氨水得到的氨气中含有水蒸气,故B错误;
C.氨气易溶于水,不能用溶液制备氨气,氨气为碱性气体,不能用浓硫酸干燥,故C错误;
D.实验室用氯化铵和消石灰反应制备氨气,氨气为碱性气体,可用碱石灰干燥,故D正确.
故选D.
点评 本题考查氨气的制备和干燥,侧重于氨气性质的考查,较为基础,难度不大,实验室制备氨气可用氯化铵和消石灰反应,也可用浓氨水和碱石灰或氢氧化钠固体制备.

练习册系列答案
相关题目
11.有机物:①正戊烷 ②异戊烷 ③新戊烷 ④正丁烷⑤异丁烷,它们的沸点按由低到高的顺序排列正确的是( )
| A. | ④<⑤<①<②<③ | B. | ⑤<④<③<②<① | C. | ①<②<④<③<⑤ | D. | ①<②<③<④<⑤ |
13. 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态原子Ti有7种能量不同的电子,基态Ti3+的未成对电子有1个.
②LiBH4由Li+和BH4-构成,BH4-的立体构型是sp3杂化,LiBH4中不存在的作用力
有c(填字母).a.离子键 b.共价键 c.金属键 d.配位键
③Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
M是Mg(填元素符号).
(3)氨硼烷(NH3BH3)与镧镍合金(LaNix)都是优良的储氢材料.
①H3BNH3的等电子体的化学式为C2H6.
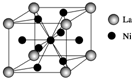
②镧镍合金的晶胞结构示意图如图所示(只有1个原子位于晶胞内部),则x=5.氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石.则在下列各项中,立方氮化硼晶体不可用作c(填字母).
a.耐磨材料 b.切削工具 c.导电材料 d.钻探钻头.
 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态原子Ti有7种能量不同的电子,基态Ti3+的未成对电子有1个.
②LiBH4由Li+和BH4-构成,BH4-的立体构型是sp3杂化,LiBH4中不存在的作用力
有c(填字母).a.离子键 b.共价键 c.金属键 d.配位键
③Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1 | I2 | I3 | I4 | I5 | |
| I/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
(3)氨硼烷(NH3BH3)与镧镍合金(LaNix)都是优良的储氢材料.
①H3BNH3的等电子体的化学式为C2H6.
②镧镍合金的晶胞结构示意图如图所示(只有1个原子位于晶胞内部),则x=5.氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石.则在下列各项中,立方氮化硼晶体不可用作c(填字母).
a.耐磨材料 b.切削工具 c.导电材料 d.钻探钻头.
10.1898年,居里夫人经过一段漫长、枯燥而又艰苦的工作,终于从数吨沥青铀矿中提炼出一小撮放射性粉末,并分离出了两种放射性元素钋和镭,其中镭是元素周期表中第7周期ⅡA族的元素.下列关于镭的性质描述中不正确的是( )
| A. | 在化合物中呈现+2价 | B. | 氢氧化物呈强碱性 | ||
| C. | 单质与冷水不反应 | D. | 碳酸盐难溶于水 |
11.光导纤维被广泛应用于光缆通讯,其主要成分是( )
| A. | CuO | B. | SiO2 | C. | Al2O3 | D. | Fe2O3 |
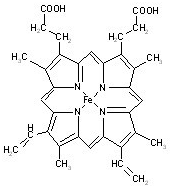 血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.
血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.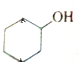 )中有3个手性碳原子.
)中有3个手性碳原子.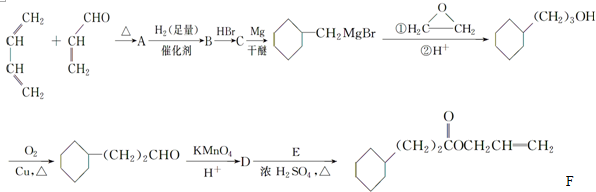
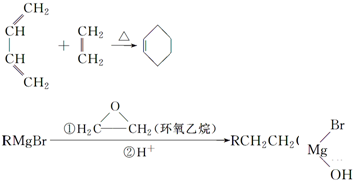
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
. .
.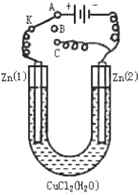 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接:
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接: