题目内容
18. 在200℃下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol含硫产物的数据).由图得出的结论正确的是( )
在200℃下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g).反应过程和能量关系可用下图简单表示(图中的△H表示生成1mol含硫产物的数据).由图得出的结论正确的是( )| A. | S8(s)的燃烧热△H=-8a kJ•mol-1 | |
| B. | 2SO3(g)═2SO2(g)+O2(g)△H=-2b kJ•mol-1 | |
| C. | S8(s)+8O2(g)═8SO2(g)△H=-a kJ•mol-1 | |
| D. | 由1 mol S8(s)生成SO2的反应热△H=-(a+b) kJ•mol-1 |
分析 A.依据燃烧热概念分析计算;
B.1molSO3分解吸收b kJ热量;
C.1molO2和$\frac{1}{8}$molS8反应生成二氧化硫放热aKJ;
D.1molS8(s)生成SO3(g)放出8(a+b)KJ热量.
解答 解:A.依据图象分析1molO2和$\frac{1}{8}$molS8反应生成二氧化硫放热aKJ/mol,依据燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式为:S8(s)+8O2(g)=8SO2(g)△H=-8aKJ/mol,则S8(s)的燃烧热△H=-8akJ•mol-1,故A正确;
B.1molO2和$\frac{1}{8}$molS8反应生成二氧化硫放热aKJ,则2SO3(g)?2SO2(g)+O2(g);△H=+2b kJ•mol-1,故B错误;
C.1molO2和$\frac{1}{8}$molS8反应生成二氧化硫放热aKJ,则S8(s)+8O2(g)=8SO2(g);△H=-8a kJ•mol-1;故C错误;
D.1molS8(s)生成SO3(g)放出8(a+b)KJ热量,则由1molS8(s)生成SO3(g)的反应热△H=-8(a+b)kJ•mol-1,故D错误;
故选A.
点评 本题考查了反应能量变化的分析判断,焓变的计算应用,反应热和键能的计算关系应用,图象分析和概念理解是解题关键,题目难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
8.某元素Mn+核外共有x个电子,该原子质量数为a,则该原子核内含有的中子数为( )
| A. | a-x+n | B. | a+x+n | C. | a-n+x | D. | a-x-n |
13. 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态原子Ti有7种能量不同的电子,基态Ti3+的未成对电子有1个.
②LiBH4由Li+和BH4-构成,BH4-的立体构型是sp3杂化,LiBH4中不存在的作用力
有c(填字母).a.离子键 b.共价键 c.金属键 d.配位键
③Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
M是Mg(填元素符号).
(3)氨硼烷(NH3BH3)与镧镍合金(LaNix)都是优良的储氢材料.
①H3BNH3的等电子体的化学式为C2H6.
②镧镍合金的晶胞结构示意图如图所示(只有1个原子位于晶胞内部),则x=5.氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石.则在下列各项中,立方氮化硼晶体不可用作c(填字母).
a.耐磨材料 b.切削工具 c.导电材料 d.钻探钻头.
 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态原子Ti有7种能量不同的电子,基态Ti3+的未成对电子有1个.
②LiBH4由Li+和BH4-构成,BH4-的立体构型是sp3杂化,LiBH4中不存在的作用力
有c(填字母).a.离子键 b.共价键 c.金属键 d.配位键
③Li、B、H元素的电负性由大到小排列顺序为H>B>Li.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+<H-(填“>”、“=”或“<”).
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:
| I1 | I2 | I3 | I4 | I5 | |
| I/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
(3)氨硼烷(NH3BH3)与镧镍合金(LaNix)都是优良的储氢材料.
①H3BNH3的等电子体的化学式为C2H6.
②镧镍合金的晶胞结构示意图如图所示(只有1个原子位于晶胞内部),则x=5.氨硼烷在高温下释放氢后生成的立方氮化硼晶体,具有类似金刚石的结构,硬度略小于金刚石.则在下列各项中,立方氮化硼晶体不可用作c(填字母).
a.耐磨材料 b.切削工具 c.导电材料 d.钻探钻头.
3.比较下面各组热化学方程式,△H1<△H2的是( )
| A. | 2H2(g)+O2(g)=2H2O(g )△H1 2H2(g)+O2(g)=2H2O(1)△H2 | |
| B. | S(g)+O2(g)=SO2(g )△H1 S(s)+O2(g)=SO2(g )△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO (g )△H1 C(s)+O2(g)=CO2 (g )△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g )△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g )△H2 |
10.1898年,居里夫人经过一段漫长、枯燥而又艰苦的工作,终于从数吨沥青铀矿中提炼出一小撮放射性粉末,并分离出了两种放射性元素钋和镭,其中镭是元素周期表中第7周期ⅡA族的元素.下列关于镭的性质描述中不正确的是( )
| A. | 在化合物中呈现+2价 | B. | 氢氧化物呈强碱性 | ||
| C. | 单质与冷水不反应 | D. | 碳酸盐难溶于水 |
7.部分难溶物的颜色和常温下的Ksp如下表所示:
某研究性学习小组对电解食盐水进行了如下探究:
实验Ⅰ:装置如图所示,接通电源后,发现a、b电极上均有气泡产生.
(1)电解过程中的总离子反应方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)为了确定电源的正、负极,下列操作一定行之有效的是BD.
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ:把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图所示.
观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色.
(3)a极发生的电极反应方程式为:2H++2e-=H2↑(或2H2O+2e-═2OH-+H2↑).
(4)电解5min后,b极发生的电极反应方程式为:Cu+Cl--e-═CuCl↓.
(5)12min后,b极附近出现的橙黄色沉淀的成分是CuOH和Cu2O,原因是Ksp(CuOH)<Ksp(CuCl),CuCl转化为黄色的CuOH沉淀,CuOH不稳定分解生成Cu2O,所以橙黄色沉淀的成分为CuOH和Cu2O的混合物.
| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | - |

实验Ⅰ:装置如图所示,接通电源后,发现a、b电极上均有气泡产生.
(1)电解过程中的总离子反应方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)为了确定电源的正、负极,下列操作一定行之有效的是BD.
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ:把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图所示.
观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10min后,最靠近a极的白色沉淀开始变成红色;
④12min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色.
(3)a极发生的电极反应方程式为:2H++2e-=H2↑(或2H2O+2e-═2OH-+H2↑).
(4)电解5min后,b极发生的电极反应方程式为:Cu+Cl--e-═CuCl↓.
(5)12min后,b极附近出现的橙黄色沉淀的成分是CuOH和Cu2O,原因是Ksp(CuOH)<Ksp(CuCl),CuCl转化为黄色的CuOH沉淀,CuOH不稳定分解生成Cu2O,所以橙黄色沉淀的成分为CuOH和Cu2O的混合物.
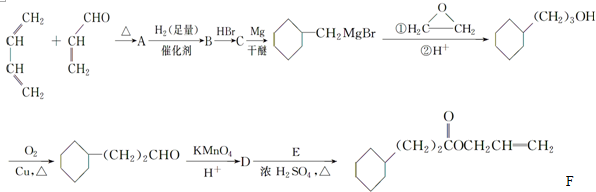
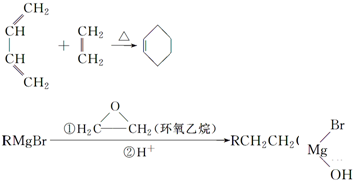
 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键. .
. .
. 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接:
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接: