题目内容
下列叙述正确的是( )
①pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
②Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
③某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
④在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
⑤1.0×10-3 mol/L盐酸的pH=3.0;1.0×10-8 mol/L盐酸的pH=8.0
⑥若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
⑦10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL.
①pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
②Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
③某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
④在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
⑤1.0×10-3 mol/L盐酸的pH=3.0;1.0×10-8 mol/L盐酸的pH=8.0
⑥若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
⑦10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL.
| A、①⑥ | B、②⑦ | C、③④ | D、⑤⑥ |
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:①溶液中,c(H+)=10-pH;
②Na2CO3溶液加水稀释促进水解,Kw只与温度有关;
③加水稀释醋酸促进电离,但稀释后溶液中c(H+)减小;
④酚酞的变色范围为8-10;
⑤常温下,酸溶液的pH<7;
⑥若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,说明二者的物质的量相等,则NaOH浓度为0.001mol/L;
⑦10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,如果酸为强酸,则酸溶液的体积为10mL,如果酸是弱酸,则酸溶液的体积小于10mL.
②Na2CO3溶液加水稀释促进水解,Kw只与温度有关;
③加水稀释醋酸促进电离,但稀释后溶液中c(H+)减小;
④酚酞的变色范围为8-10;
⑤常温下,酸溶液的pH<7;
⑥若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,说明二者的物质的量相等,则NaOH浓度为0.001mol/L;
⑦10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,如果酸为强酸,则酸溶液的体积为10mL,如果酸是弱酸,则酸溶液的体积小于10mL.
解答:
解:①pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)=10-pH,两种溶液的pH相等,所以其c(H+)相等,故正确;
②水的离子积常数只与温度有关,温度不变,则Kw不变,故错误;
③加水稀释醋酸促进电离,但稀释过程中醋酸电离增大程度小于溶液体积增大程度,所以稀释后溶液中c(H+)减小,所以a<b,故错误;
④酚酞的变色范围为8-10,所以在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<8,故错误;
⑤1.0×10-8 mol/L盐酸接近中性,所以该溶液的pH接近7,故错误;
⑥若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,说明盐酸和NaOH的物质的量相等,则氢氧化钠浓度为盐酸的
,为0.001mol/L,则NaOH溶液的pH=11,故正确;
⑦10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,如果酸为强酸,则酸溶液的体积为10mL,如果酸是弱酸,则酸溶液的体积小于10mL,所以所得溶液体积V(总)≤20mL,故错误;
故选A.
②水的离子积常数只与温度有关,温度不变,则Kw不变,故错误;
③加水稀释醋酸促进电离,但稀释过程中醋酸电离增大程度小于溶液体积增大程度,所以稀释后溶液中c(H+)减小,所以a<b,故错误;
④酚酞的变色范围为8-10,所以在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<8,故错误;
⑤1.0×10-8 mol/L盐酸接近中性,所以该溶液的pH接近7,故错误;
⑥若1mL pH=1的盐酸与100mL NaOH溶液混合后,溶液的pH=7,说明盐酸和NaOH的物质的量相等,则氢氧化钠浓度为盐酸的
| 1 |
| 100 |
⑦10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,如果酸为强酸,则酸溶液的体积为10mL,如果酸是弱酸,则酸溶液的体积小于10mL,所以所得溶液体积V(总)≤20mL,故错误;
故选A.
点评:本题考查弱电解质的电离、酸碱混合溶液定性判断、盐类水解等知识点,知道电离平衡常数与盐类水解平衡常数、离子积常数都只与温度有关,与溶液酸碱性及浓度无关,易错选项是⑤,酸或碱溶液接近中性时要考虑水的电离,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
已知反应a R2O72-+x M2++14H+=b R3++x M3++c H2O,则系数x的值是( )
| A、3 | B、4 | C、5 | D、6 |
下列叙述错误的是( )
| A、配制FeCl3溶液,为了抑制水解,常加盐酸 |
| B、盐类都能水解 |
| C、盐类水解反应通常为吸热反应 |
| D、盐类水解是指组成盐的离子跟水电离出的H+或OH-离子生成弱电解质的反应 |
NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A、标准状况下,2.24LH2O含有的分子数等于0.1NA |
| B、常温下,100 mL 1mol/L Na2CO3溶液中钠离子总数为0.1NA |
| C、分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g |
| D、3.4g NH3中含NH3分子数目为0.2NA |
下列4种鉴别碳酸钠和碳酸氢钠的方法中,可靠性最差的是( )
| A、观察样品外观 |
| B、在少量的样品中滴入几滴水 |
| C、在饱和溶液中滴入几滴酚酞 |
| D、取少量的试样加热 |
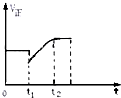 如图表示反应N2(g)+3H2(g)?2NH3(g)+Q的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )
如图表示反应N2(g)+3H2(g)?2NH3(g)+Q的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )| A、t1时只减小了压强 |
| B、t1时只降低了温度 |
| C、t1时减小了NH3的浓度,平衡向正反应方向移动 |
| D、t1时减小N2浓度,同时增加了NH3的浓度 |
下列叙述正确的是( )
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | ||
| B、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | ||
| C、某种物质溶于水形成酸性溶液,该物质可能是强酸与强碱反应形成的盐 | ||
D、向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中
|