题目内容
NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A、标准状况下,2.24LH2O含有的分子数等于0.1NA |
| B、常温下,100 mL 1mol/L Na2CO3溶液中钠离子总数为0.1NA |
| C、分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g |
| D、3.4g NH3中含NH3分子数目为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标况下,水为液态;
B、根据n=cV并结合 Na2CO3的化学式来分析;
C、只有标况下,气体摩尔体积才是22.4mol/L;
D、根据n=
来分析.
B、根据n=cV并结合 Na2CO3的化学式来分析;
C、只有标况下,气体摩尔体积才是22.4mol/L;
D、根据n=
| m |
| M |
解答:
解:A、标况下,水为液态,故A错误;
B、100 mL 1mol/L Na2CO3的物质的量n=cV=0.1L×1mol/L=0.1mol,故含钠离子的物质的量为0.2mol,个数为0.2NA,故B错误;
C、只有标况下,气体摩尔体积才是22.4mol/L,故分子数为NA的CO、N2混合气体体积不一定为22.4L,故C错误;
D、3.4g NH3的n=
=
=0.2mol,故分子数为0.2NA个,故D正确.
故选D.
B、100 mL 1mol/L Na2CO3的物质的量n=cV=0.1L×1mol/L=0.1mol,故含钠离子的物质的量为0.2mol,个数为0.2NA,故B错误;
C、只有标况下,气体摩尔体积才是22.4mol/L,故分子数为NA的CO、N2混合气体体积不一定为22.4L,故C错误;
D、3.4g NH3的n=
| m |
| M |
| 3.4g |
| 17g/mol |
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用以及物质的结构是解题关键,难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
下列实验中(固定仪器省略),没有错误的是( )
A、 |
B、 |
C、 |
D、 |
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.06mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.06mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
| A、K+一定存在 |
| B、100mL溶液中含0.01 mol CO32- |
| C、Ba2+一定不存在,Mg2+可能存在 |
| D、K+、Cl-可能存在 |
反应:NO+CO2?NO2+CO在密闭容器中进行,下列哪项条件加快该反应速率( )
| A、缩小体积使压强增大 |
| B、体积不变充入CO2使压强增大 |
| C、体积不变充入He气使压强增大 |
| D、压强不变充入N2使体积增大 |
中和10mL1.0mol/L的盐酸,需用等体积的NaOH溶液和氨水,则NaOH和氨水的( )
| A、C (OH-)相同 |
| B、pH值相同 |
| C、溶质的质量相同 |
| D、溶质的物质的量相同 |
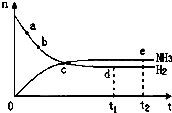 合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:
合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:N2(g)+3H2(g)
| 催化剂 |
| 高温、高压 |
| A、点a的正反应速率比b点的大 |
| B、点c处反应还未达到平衡 |
| C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D、其他条件不变,500℃下反应至t1时刻,n(H2)比图中d点的值大 |
下列实验对应的结论正确的是( )
| A | B | C | D | |
| 装置 |  |  |  |  洗气瓶中产生白色沉淀 |
| 结论 | 用浓盐酸与高锰酸钾制氯气 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶液反应生成的碘 | 白色沉淀是BaSO3 |
| A、A | B、B | C、C | D、D |
下列变化不属于水解反应的是( )
| A、吃馒头时多咀嚼后有甜味 |
| B、不慎将浓硝酸沾到皮肤上会出现黄色斑痕 |
| C、油脂和氢氧化钠溶液共热后可制得肥皂 |
| D、蛋白质在胃蛋白酶或胰蛋白酶作用下转变为氨基酸 |