题目内容
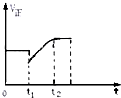 如图表示反应N2(g)+3H2(g)?2NH3(g)+Q的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )
如图表示反应N2(g)+3H2(g)?2NH3(g)+Q的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )| A、t1时只减小了压强 |
| B、t1时只降低了温度 |
| C、t1时减小了NH3的浓度,平衡向正反应方向移动 |
| D、t1时减小N2浓度,同时增加了NH3的浓度 |
考点:化学反应速率与化学平衡图象的综合应用
专题:化学平衡专题
分析:根据图知,t1时正反应速率减小,且随着反应的进行,正反应速率逐渐增大,说明平衡向逆反应方向移动,当达到平衡状态时,正反应速率大于原来平衡反应速率,说明反应物浓度增大,据此分析解答.
解答:
解:根据图知,t1时正反应速率减小,且随着反应的进行,正反应速率逐渐增大,说明平衡向逆反应方向移动,当达到平衡状态时,正反应速率大于原来平衡反应速率,说明反应物浓度增大,
A.t1时只减小了压强,平衡向逆反应方向移动,则正反应速率增大,但平衡时正反应速率小于原来平衡反应速率,故A错误;
B.t1时只降低了温度,平衡向正反应发现移动,正反应速率逐渐减小,故B错误;
C.t1时减小了NH3的浓度,平衡向正反应方向移动,但正反应速率在改变条件时刻不变,故C错误;
D.t1时减小N2浓度,同时增加了NH3的浓度,平衡向逆反应方向移动,如果增加氨气浓度大于减少氮气浓度的2倍时,达到平衡状态,氮气浓度大于原来浓度,则正反应速率大于原来平衡反应速率,故D正确;
故选D.
A.t1时只减小了压强,平衡向逆反应方向移动,则正反应速率增大,但平衡时正反应速率小于原来平衡反应速率,故A错误;
B.t1时只降低了温度,平衡向正反应发现移动,正反应速率逐渐减小,故B错误;
C.t1时减小了NH3的浓度,平衡向正反应方向移动,但正反应速率在改变条件时刻不变,故C错误;
D.t1时减小N2浓度,同时增加了NH3的浓度,平衡向逆反应方向移动,如果增加氨气浓度大于减少氮气浓度的2倍时,达到平衡状态,氮气浓度大于原来浓度,则正反应速率大于原来平衡反应速率,故D正确;
故选D.
点评:本题考查化学平衡图象分析,明确图中反应速率与物质浓度关系是解本题关键,会根据图象曲线变化确定反应方向,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在0℃1.01×105Pa下,对H2,O2,CH4三种气体叙述正确的是( )
| A、其密度之比等于物质的量之比 |
| B、其密度之比等于摩尔质量之比 |
| C、等质量的三种气体,其体积之比等于相对分子质量的倒数比 |
| D、等体积的三种气体,其物质的量之比等于相对分子质量之比 |
中和10mL1.0mol/L的盐酸,需用等体积的NaOH溶液和氨水,则NaOH和氨水的( )
| A、C (OH-)相同 |
| B、pH值相同 |
| C、溶质的质量相同 |
| D、溶质的物质的量相同 |
下列有关离子晶体的数据大小比较不正确的是( )
| A、熔点:NaF>MgF2>AlF3 |
| B、晶格能:NaF>NaCl>NaBr |
| C、阴离子的配位数:CsCl>NaCl>CaF2 |
| D、硬度:MgO>CaO>BaO |
下列实验对应的结论正确的是( )
| A | B | C | D | |
| 装置 |  |  |  |  洗气瓶中产生白色沉淀 |
| 结论 | 用浓盐酸与高锰酸钾制氯气 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶液反应生成的碘 | 白色沉淀是BaSO3 |
| A、A | B、B | C、C | D、D |
下列说法正确的是( )
| A、含有氧元素的化合物一定是氧化物 |
| B、在水溶液中能电离出H+的化合物一定是酸 |
| C、盐一定是有金属阳离子和酸根离子构成 |
| D、HCl不导电 |
下列说法正确的是( )
| A、构成原电池正极和负极的材料必须是金属 |
| B、在原电池中,电子流出的一极是负极,该电极被还原 |
| C、实验室欲快速制取氢气,可利用粗锌与稀硫酸反应 |
| D、原电池可以把物质内部的能量全部转化为电能 |
下列是有关实验操作的步骤和做法,不正确的是( )
| A、粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 |
| B、萃取操作时,所选萃取剂的密度没有特别限制 |
| C、蒸馏操作时,冷凝管从上面进水,从下面出水 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |