题目内容
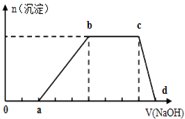 某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、Cu2+、SO42-、I-、CO32-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知:
某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、Cu2+、SO42-、I-、CO32-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知:(1)该溶液中肯定含有的阳离子是
(2)取部分原溶液,加入BaCl2溶液,有白色沉淀生成.过滤除去沉淀后,向滤液中滴入几滴氯水,再加入少量四氯化碳,振荡后静置,四氯化碳呈紫色.则原溶液中肯定存在的阴离子是
(3)写出在线段cd时反应的离子方程式
考点:常见阳离子的检验,离子共存问题,常见阴离子的检验
专题:离子反应专题
分析:(1)根据图象第一段,没有生成沉淀,说明一定含有氢离子,酸碱中和反应是一切反应的优先反应,生成沉淀在后面完全溶解,说明一定含有铝离子,肯定不含有Mg2+、Fe3+、Cu2+、CO32-,根据第三段,和氢氧化钠反应不产生沉淀,说明一定含有铵根离子;根据坐标得与氢离子反应的氢氧化钠为2体积,生成沉淀用了3体积的氢氧化钠,与铵根反应用了3体积氢氧化钠,依据图象定量关系,结合反应需要的氢氧化钠的量,计算各离子物质的量之比;
(2)取部分原溶液,加入BaCl2溶液,有白色沉淀生成,说明含有SO42-;向滤液中滴入几滴氯水,再加入少量四氯化碳,振荡后静置,四氯化碳呈紫色,说明生成的单质碘,故含有I-;
(3)c-d段为氢氧化铝沉淀溶解与氢氧化钠,氢氧化铝与氢氧化钠反应生成偏铝酸钠和水.
(2)取部分原溶液,加入BaCl2溶液,有白色沉淀生成,说明含有SO42-;向滤液中滴入几滴氯水,再加入少量四氯化碳,振荡后静置,四氯化碳呈紫色,说明生成的单质碘,故含有I-;
(3)c-d段为氢氧化铝沉淀溶解与氢氧化钠,氢氧化铝与氢氧化钠反应生成偏铝酸钠和水.
解答:
解:(1)根据0-a段,没有生成沉淀,说明一定含有氢离子,酸碱中和反应是一切反应的优先反应,生成沉淀在后面完全溶解,说明一定含有铝离子,肯定不含有Mg2+、Fe3+、Cu2+,根据b-c段,和氢氧化钠反应不产生沉淀,说明一定含有铵根离子;即原溶液中含有的阳离子是H+、NH4+、Al3+,肯定不含有Mg2+、Fe3+、Cu2+、CO32-;根据坐标得与氢离子反应的氢氧化钠为2体积,生成沉淀用了3体积的氢氧化钠,与铵根反应用了3体积氢氧化钠,故H+、NH4+、Al3+的物质的量之比为2:3:1,
故答案为:H+、NH4+、Al3+,2:3:1,Mg2+、Fe3+、Cu2+;
(2)取部分原溶液,加入BaCl2溶液,有白色沉淀生成,说明含有SO42-;向滤液中滴入几滴氯水,再加入少量四氯化碳,振荡后静置,四氯化碳呈紫色,说明生成的单质碘,故含有I-,
故答案为:SO42-、I-;
(3)c-d段为氢氧化铝沉淀溶解与氢氧化钠,方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
故答案为:H+、NH4+、Al3+,2:3:1,Mg2+、Fe3+、Cu2+;
(2)取部分原溶液,加入BaCl2溶液,有白色沉淀生成,说明含有SO42-;向滤液中滴入几滴氯水,再加入少量四氯化碳,振荡后静置,四氯化碳呈紫色,说明生成的单质碘,故含有I-,
故答案为:SO42-、I-;
(3)c-d段为氢氧化铝沉淀溶解与氢氧化钠,方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评:本题是一道有关离子检验的综合知识题目,考查角度很广,难度较大.

练习册系列答案
相关题目
NA为阿伏伽德罗常数.下列说法正确的是( )
| A、同温同压同体积的CO2和SO2所含氧原子数均为2NA |
| B、32gCu与S完全反应转移的电子数为NA |
| C、1L 1.0mol?L-1 NH4Cl与2L 0.5mol?L-1 NH4Cl溶液含NH4+数目相同 |
| D、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.1NA |
 如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )
如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )| A、X元素的原子有二个电子层,处于周期表的第14纵行 |
| B、X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 |
| C、Z的原子序数为31,单质常温下为液体 |
| D、气态氢化物水溶液的酸性X<Z<Y |
下列说法正确的是( )
| A、煤的干馏、石油的分馏都是物理变化 |
| B、工业上常用澄清石灰水和氯气反应制漂白粉 |
| C、蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,都属于“盐析” |
| D、二氧化硅可以用于制造光导纤维,光导纤维遇强碱会“断路” |
常温下,下列有关物质的量浓度关系正确的是( )
| A、等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH |
| B、pH相同的溶液中:c(Na2CO3)<c(NaHCO3) |
| C、在Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-) |
| D、0.1mol?L-1 NaHS溶液中:c(Na+)=c(HS-) |

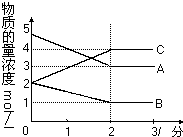 在密闭容器中,某反应在不同反应时间各物质的量的变化情况如右图所示(各物质均为气体).
在密闭容器中,某反应在不同反应时间各物质的量的变化情况如右图所示(各物质均为气体).