题目内容
常温下,下列有关物质的量浓度关系正确的是( )
| A、等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH |
| B、pH相同的溶液中:c(Na2CO3)<c(NaHCO3) |
| C、在Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-) |
| D、0.1mol?L-1 NaHS溶液中:c(Na+)=c(HS-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大,其抑制水电离程度越大;
B.碳酸根离子水解程度远远大于碳酸氢根离子,酸根离子水解程度越大,相同PH的钠盐溶液的浓度越小;
C.任何电解质溶液中都存在电荷守恒;
D.在水溶液中,HS-电离和水解.
B.碳酸根离子水解程度远远大于碳酸氢根离子,酸根离子水解程度越大,相同PH的钠盐溶液的浓度越小;
C.任何电解质溶液中都存在电荷守恒;
D.在水溶液中,HS-电离和水解.
解答:
解:A.酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大,其抑制水电离程度越大,等物质的量浓度的HCl和CH3COOH中,HCl中氢离子浓度大于醋酸,所以水电离出的c(H+):HCl<CH3COOH,故A错误;
B.酸根离子水解程度越大,相同PH的钠盐溶液的浓度越小,碳酸根离子水解程度远远大于碳酸氢根离子,所以pH相同的溶液中:c(Na2CO3)<c(NaHCO3),故B正确;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-),故C错误;
D.在水溶液中,HS-电离和水解,钠离子不水解,所以c(Na+)>c(HS-),故D错误;
故选B.
B.酸根离子水解程度越大,相同PH的钠盐溶液的浓度越小,碳酸根离子水解程度远远大于碳酸氢根离子,所以pH相同的溶液中:c(Na2CO3)<c(NaHCO3),故B正确;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-),故C错误;
D.在水溶液中,HS-电离和水解,钠离子不水解,所以c(Na+)>c(HS-),故D错误;
故选B.
点评:本题考查了离子浓度大小比较,根据溶液酸碱性、盐类水解及弱电解质的电离特点来分析解答,注意结合电荷守恒、物料守恒进行分析,题目难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、向氢氧化钠溶液中加入少量铝粉:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、硫化钠溶液显碱性的原因:S2-+H2O═H2S+2OH- |
| D、向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
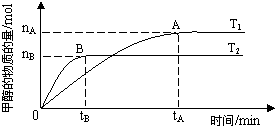
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )| A、该反应进行到M点放出的热量大于进行到W点放出的热量 | ||
B、T2下,在0~t1时间内,v(Y)=
| ||
| C、M点的正反应速率V正大于N点的逆反应速率V逆 | ||
| D、M点时再加入一定量X,平衡后X的转化率减小 |
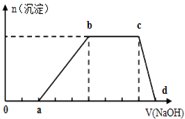 某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、Cu2+、SO42-、I-、CO32-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知:
某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、Cu2+、SO42-、I-、CO32-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知: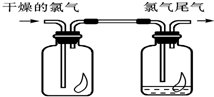 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是