题目内容
17. 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.(1)组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是第三周期第VA族
(2)氧硫化碳(COS)的电子式为:
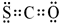 .
.(3)下列事实正确且能说明碳与硫两元素非金属性相对强弱的有AC
A.同条件同浓度溶液pH:Na2CO3>Na2SO4
B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
D.分解温度:CH4>H2S
(4)氧硫化碳水解及部分应用流程如下(部分产物已略去):
COS$→_{Ⅰ}^{H_{2}O}$H2S$→_{Ⅱ}^{NaOH溶液}$Na2S溶液$→_{Ⅲ}^{△}$M溶液+H2
①已知:常温下,反应Ⅱ中每吸收1.7gH2S气体,反应放出热量4.76kJ,则该反应的热化学方程式为H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-95.2KJ/mol
②已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-
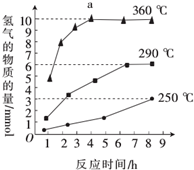
③如图是反应Ш中,在不同反应温度下,反应时间与H2产量的关系(Na2 S初始含量为3 mmol).由图象分析可知,a点时M溶液中除S2O32-外,还有SO42-(填含硫微粒的 离子符号).
分析 (1)组成氧硫化碳和磷化氢的原子为O、S、P、H,先判断电子层数,电子层数越多,原子半径越大;电子层数相同,再根据元素周期律,同周期元素的原子半径随着原子序数的增大而减小,主族元素周期数=电子层数,主族序数=最外层电子数;
(2)氧硫化碳是碳原子和硫原子、氧原子分别形成两个共价键,据此书写电子式;
(3)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度以及最高正价氧化物对应水化物酸性强弱;
(4)①依据热化学方程式书写方法,标注物质的聚集状态和对应反应的焓变写出热化学方程式;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,依据电荷守恒和原子守恒书写离子反应方程式;
③根据图示反应时间与H2产量的关系,a点时M溶液中除S2O32-外,还有SO42-.
解答 解:(1)组成氧硫化碳和磷化氢的原子为O、S、P、H,氢元素有1个电子层,氧元素有2个电子层,磷、硫有3个电子层,所以磷、硫的原子半径大于氢、氧的原子半径,磷、硫是同周期元素,硫的原子序数大于磷的原子序数,由元素周期律知,磷的原子半径大于硫的原子半径,磷最外层为5个电子,处于第三周期第VA族,
故答案为:第三周期第VA族;
(2)羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为 ,
,
故答案为: ;
;
(3)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度以及最高正价氧化物对应水化物酸性强弱等角度,而最高正化合价、氢化物的沸点高低不能用于比较元素的非金属性强弱,
A.同条件同浓度溶液pH:Na2CO3>Na2SO4,说明碳酸酸性小于硫酸,最高价氧化物对应水化物形成的酸的酸性越强对应非金属性越强,故A正确;
B.酸性:H2SO3>H2CO3 ,亚硫酸不是最高价氧化物,不能判断非金属性强弱,故B错误;
C.CS2中碳元素为+4价,硫元素为-2价,说明硫元素对共用电子对的吸引力较强,说明非金属性:S>C,故C正确;
D.一般来说,元素的气态氢化物越稳定,则元素的非金属性越强,分解温度:CH4>H2S,氢化物的稳定性顺序是CH4>H2S,但S的非金属性强于碳元素,故D错误;
故答案为:AC;
(4)①反应Ⅱ为硫化氢和氢氧化钠的反应H2S+2NaOH=Na2S+H2O,1.7g H2S的物质的量为n=$\frac{m}{M}$=$\frac{17g}{34g/mol}$=0.5mol,反应放出热量4.76kJ,则1mol硫化氢反应放出95.2KJ的热量,所以该反应的热化学方程式为H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-95.2KJ/mol,
故答案为:H2S(g)+2NaOH(aq)=Na2S(aq)+2H2O(l)△H=-95.2KJ/mol;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有因离子,根据原子守恒,产物还有氢氧根离子,反应为:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,
故答案为:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-;
③反应Ⅲ中,a点360℃时,随着时间推移,氢气的量不变,Na2S初始含量为3mmol,若只发生:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,生成氢气:3mmol×$\frac{4}{2}$=6mmol,图中为9mmol,说明M溶液中除S2O32-外,还有SO42-,反应为:S2-+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$SO42-+4H2↑,
故答案为:SO42-.
点评 本题考查了原子半径大小的比较、非金属性强弱比较、热反应方程式的书写、离子反应方程式的书写等,注意电子层结构相同的离子半径大小的比较方法.注意元素非金属性和金属性的比较角度,题目难度中等.

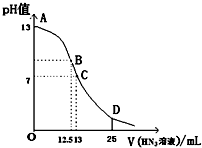 纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL 0.1mol•L-1NaOH溶液中加入0.2mol•L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图.下列说法正确的是( )
纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL 0.1mol•L-1NaOH溶液中加入0.2mol•L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图.下列说法正确的是( )| A. | 若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂 | |
| B. | 常温下,向0.2mol•L-1HN3的溶液中加水稀释,则 $\frac{c({{N}_{3}}^{-})}{c(O{H}^{-})•c(H{N}_{3})}$不变 | |
| C. | 分别中和PH均为4的HN3溶液和HCl溶液,消耗0.1mol•L-1NaOH溶液的体积相同 | |
| D. | D点时溶液中离子浓度存在如下关系:c(H+)+c(HN3)=c(N3-)+c(OH-) |
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
(1)该实验的目的是研究反应物I-与S2O82-的浓度对反应速率的影响.
(2)显色时间t1=29.3s.
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为A(填字母).
A.<22.0s B.22.0~44.0sC.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是反应速率与反应物起始浓度乘积成正比或显色时间与反应物起始浓度乘积成反比.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | O |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 四 | ⑧ | ⑨ | ⑩ |
(2)①~⑩元素中,最高价氧化物对应的水化物呈两性的元素是Al(填元素符号),该水化物与NaOH溶液反应的离子方程式为Al (OH)3+OH-=AlO2-+2H2O.
(3)①~⑩元素中,最高价氧化物对应的水化物的酸性最强的元素是Cl(填元素符号,下同),碱性最强的元素是K.
(4)⑤、⑥、⑧、⑨所形成的简单离子的半径由大到小的顺序是S2->Cl->K+>Ca2+.
| A. |  3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | B. |  2-羟基丁烷 2-羟基丁烷 | ||
| C. |  2-乙基丁烷 2-乙基丁烷 | D. |  邻羟基苯甲酸 邻羟基苯甲酸 |
| A. | 1mol Cl2与足量Fe反应,转移的电子数为2nA | |
| B. | 19.2g纯铜理论上可以制得纯净的硝酸铜的物质的量为0.3NA | |
| C. | 1.8 gAl与足量的盐酸反应放出的氢气为0.1NA | |
| D. | 0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA |
 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得: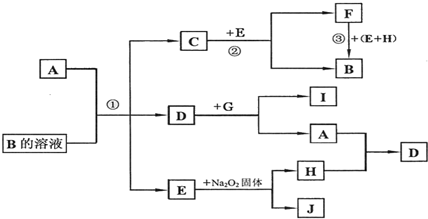
 .
.