题目内容
5.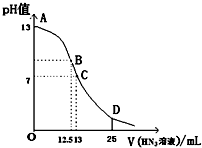 纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL 0.1mol•L-1NaOH溶液中加入0.2mol•L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图.下列说法正确的是( )
纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25mL 0.1mol•L-1NaOH溶液中加入0.2mol•L-1HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图.下列说法正确的是( )| A. | 若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂 | |
| B. | 常温下,向0.2mol•L-1HN3的溶液中加水稀释,则 $\frac{c({{N}_{3}}^{-})}{c(O{H}^{-})•c(H{N}_{3})}$不变 | |
| C. | 分别中和PH均为4的HN3溶液和HCl溶液,消耗0.1mol•L-1NaOH溶液的体积相同 | |
| D. | D点时溶液中离子浓度存在如下关系:c(H+)+c(HN3)=c(N3-)+c(OH-) |
分析 A.NaOH与HN3等物质的量反应后溶液显碱性,说明HN3为弱酸,滴定时选择在碱性条件下变色的指示剂;
B. $\frac{c({{N}_{3}}^{-})}{c(O{H}^{-})•c(H{N}_{3})}$=$\frac{Ka}{Kw}$;
C.PH均为4的HN3溶液和HCl溶液,HN3的浓度大于HCl;
D.D点时,加入的HN3的物质的量是NaOH的2倍,根据物料守恒和电荷守恒分析.
解答 解:A.NaOH与HN3等物质的量反应后溶液显碱性,说明HN3为弱酸,滴定时选择在碱性条件下变色的指示剂,所以选择酚酞作指示剂,故A错误;
B. $\frac{c({{N}_{3}}^{-})}{c(O{H}^{-})•c(H{N}_{3})}$=$\frac{Ka}{Kw}$,Ka、Kw为常数,只随温度的变化而变化,温度不变,所以加水稀释 $\frac{c({{N}_{3}}^{-})}{c(O{H}^{-})•c(H{N}_{3})}$不变,故B正确;
C.PH均为4的HN3溶液和HCl溶液,两个溶液中氢离子的浓度相同,HN3的浓度大于氢离子,HCl的浓度等于氢离子,所以HN3的浓度大于HCl,则HN3消耗的氢氧化钠体积大,故C错误;
D.D点时,加入的HN3的物质的量是NaOH的2倍,溶液中物料守恒为2c(Na+)=c(HN3)+c(N3-),电荷守恒为c(H+)+c(Na+)=c(N3-)+c(OH-),
则:2c(H+)+c(HN3)=c(N3-)+2c(OH-),故D错误.
故选B.
点评 本题考查了图象变化的分析、酸碱反应溶液酸碱性、盐类水解原理、电解质溶液中离子浓度大小的比较方法等知识,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握图象中的点对应的溶质.

 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | CO2 H2O | B. | C2H4 CH4 | C. | Cl2 CH4 | D. | NH3 HCl |
 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 78.5℃ | 100℃ |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{60℃-80℃}^{CuO}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A 的反应液中,目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A 的支管口处,目的是收集含乙酸的馏分
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,烧杯B内盛装的液体可以是甘油(在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末.实验仪器任选.该方案为将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸.(或把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成).
| A. | Mg(OH)2悬浊液 | B. | 稀盐酸 | C. | K2SO4溶液 | D. | Fe(OH)3胶体 |
| A. |  | B. |  | ||
| C. | CH3CH2COOH | D. |  |
| A. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | B. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(H+)=c(OH-) | D. | c(Na+)=c(CH3COO-)>c(OH-)>c(H+) |
| A. | 标准状况下,11.2L甲烷中含有的碳氢键数目为2NA | |
| B. | 常温下,1L0.1mol/L的Na2CO3溶液中含有OH-离子数为0.1NA | |
| C. | 常温常压下,28gN2、CO的混合气体中含有N2分子数为0.5NA | |
| D. | 标准状况下,22.4LCl2与足量NaOH溶液反应,转移的电子数为2NA |
| A. | 物质的量为1mol | B. | 质量大于64g | ||
| C. | 含S原子数目大于NA | D. | 含O原子的物质的量小于2mol |
 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.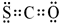 .
.