题目内容
12.下面是中学化学常见物质A-J的反应转化关系图.其中A、G、H为单质,其余为化合物;常温下C、D、F为气体,有关反应条件均已略去.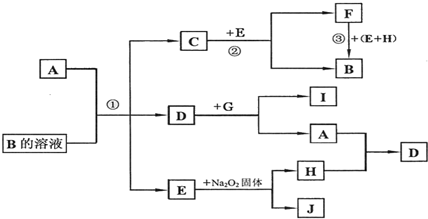
请回答下列问题:
(1)物质C、E的化学式分别为NO2;H2O.
(2)物质D的结构式为O=C=O;G可能的化学式为Mg.
(3)反应①②③的化学方程式分别为(需条件的,要注明反应条件):
①4HNO3(浓)+C $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
②3NO2+H2O═2HNO3+NO;
③4NO+3O2+2H2O═4HNO3 .
(4)将金属铝片和A的某种同素异形体作电极,一定浓度的J的水溶液作电解质溶液构成原电池,则原电池的负极的电极反应为:Al+4OH--3e-═AlO2-+2H2O;原电池总反应的离子方程式为:2Al+2OH-+2H2O═AlO2-+3H2↑.
分析 单质A与B的溶液反应得到气体C、D,应是碳与浓硫酸或浓硝酸反应,故A为碳,E为H2O,则单质H为O2,J为NaOH.而C与E(水)反应得到气体F与B,且F与水、氧气反应也得到B,可推知C为NO2,D为CO2,则F为NO,B为HNO3,二氧化碳与G反应得到碳与I,则G为Mg,I为CO.
解答 解:单质A与B的溶液反应得到气体C、D,应是碳与浓硫酸或浓硝酸反应,故A为碳,E为H2O,则单质H为O2,J为NaOH.而C与E(水)反应得到气体F与B,且F与水、氧气反应也得到B,可推知C为NO2,D为CO2,则F为NO,B为HNO3,二氧化碳与G反应得到碳与I,则G为Mg,I为CO.
(1)物质C、E的化学式分别为NO2、H2O,
故答案为:NO2;H2O;
(2)物质D为CO2,结构式为O=C=O,G可能的化学式为Mg,
故答案为:O=C=O;Mg;
(3)反应①的化学方程式为:4HNO3(浓)+C $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
反应②的化学方程式为:3NO2+H2O═2HNO3+NO,
反应③的化学方程式为:4NO+3O2+2H2O═4HNO3 ,
故答案为:4HNO3(浓)+C $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;3NO2+H2O═2HNO3+NO;4NO+3O2+2H2O═4HNO3 ;
(4)将金属铝片和碳的某种同素异形体作电极,一定浓度的NaOH的水溶液作电解质溶液构成原电池,Al为负极,负极的电极反应为:Al+4OH--3e-═AlO2-+2H2O,原电池总反应的离子方程式为:2Al+2OH-+2H2O═AlO2-+3H2↑,
故答案为:Al+4OH--3e-═AlO2-+2H2O;2Al+2OH-+2H2O═AlO2-+3H2↑.
点评 本题考查无机物的推断,转化中特殊反应是推断突破口,需要学生熟练掌握元素化合物的性质,难度之大.

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案| A. |  | B. |  | ||
| C. | CH3CH2COOH | D. |  |
请回答下列问题:
(1)请完成以下表格(表中不要留有空格):
| 实验编号 | 实验目的 | 温度 | 废水样品 | 2.0mLH2C2O4的浓度 |
| ① | 为以下实验作参照 | 273K | 4.0mL | 0.10mol?L-1 |
| ② | 298K | 4.0mL | 0.10mol?L-1 | |
| ③ | 探究浓度对反应速率的影响 | 273K | 0.20mol?L-1 |
2MnO4-+5H2C2O4+6H+═2Mn2++8H2O+10CO2↑.
(3)某课题组对摩尔氏盐[FeSO4?(NH4)2SO4?6H2O]中起加快溶液紫红色褪去的成分提出如下假设,请你完成假设二、假设三:
假设一:SO42- 起催化作用.;
假设二:Fe2+起还原作用或起催化作用;
假设三:NH4+起还原作用或起催化作用.
(4)请你设计实验验证上述假设一是否成立,完成下表中的内容.
| 实验方案(不要求写具体操作过程) | 预期的实验现象和结论 |
| 取等量的废水样品于两支试管中,… |
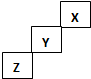
| A. | Z一定是活泼的金属元素 | |
| B. | X的最高价氧化物的水化物是一种强酸 | |
| C. | Y的气态氢化物最稳定 | |
| D. | Z单质可与盐酸反应置换出氢气 |
| A. | $\frac{ab}{22400}$mol•L-1 | B. | $\frac{ab}{22400+17a}$mol•L-1 | ||
| C. | $\frac{1000ab}{22400+35a}$mol•L-1 | D. | $\frac{1000ab}{22400+17a}$mol•L-1 |
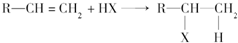
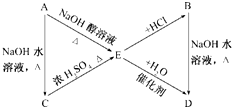
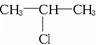 ,C:CH3CH2CH2OH,D:
,C:CH3CH2CH2OH,D: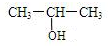 ,E:CH3CH=CH2.
,E:CH3CH=CH2.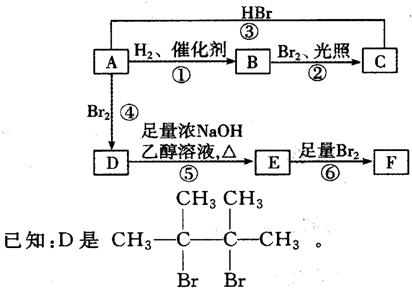
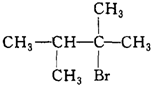 .
. ;;写出由E-F的化学方程式
;;写出由E-F的化学方程式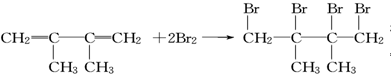 .
.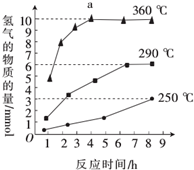 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.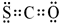 .
.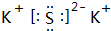 ;
;