题目内容
8.“碘钟”实验中,3I-+S2O82-═I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃下进行实验,得到 的数据如下表:| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
(1)该实验的目的是研究反应物I-与S2O82-的浓度对反应速率的影响.
(2)显色时间t1=29.3s.
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为A(填字母).
A.<22.0s B.22.0~44.0sC.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是反应速率与反应物起始浓度乘积成正比或显色时间与反应物起始浓度乘积成反比.
分析 (1)根据图表已知物理量判断;
(2)根据浓度与时间的关系计算;
(3)根据温度与反应速率的关系判断;
(4)根据图表中物理量的关系得出结论.
解答 解:(1)图表中的物理量是反应物浓度与时间,通过分析知,反应物的浓度与时间成反比,浓度的变化量与时间的比值为速率,所以得出反应物浓度与反应速率的关系,
故答案为:研究反应物I-与S2O82-的浓度对反应速率的影响;
(2)通过分析各组数据知,反应物起始浓度乘积与时间成反比,由①、⑤列比例式,
(0.040 mol•L-1×0.040mol•L-1):(0.120 mol•L-1×0.040mol•L-1)=t1:88.0s,所以t1=29.3s,
故答案为:29.3s;
(3)温度越高,化学反应速率越快,所用时间越短,
故答案为:A;
(4)通过分析知,反应物的浓度乘积与时间成反比,浓度的变化量与时间的比值为速率,
故答案为:反应速率与反应物起始浓度乘积成正比或显色时间与反应物起始浓度乘积成反比.
点评 该题图表的分析方法:先比较两组数据的不同点,再分析不同点说明的问题,从而确定它们之间关系,
如:①、②两组数据的不同点是c(I-)和时间,浓度越大,时间越短,浓度的变化量与时间的比值为速率,所以浓度越大,反应速率越快.

练习册系列答案
相关题目
16. 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{60℃-80℃}^{CuO}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A 的反应液中,目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A 的支管口处,目的是收集含乙酸的馏分
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,烧杯B内盛装的液体可以是甘油(在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末.实验仪器任选.该方案为将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸.(或把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成).
 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 78.5℃ | 100℃ |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{60℃-80℃}^{CuO}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A 的反应液中,目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在略低于试管A 的支管口处,目的是收集含乙酸的馏分
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,烧杯B内盛装的液体可以是甘油(在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末.实验仪器任选.该方案为将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸.(或把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成).
17.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2L甲烷中含有的碳氢键数目为2NA | |
| B. | 常温下,1L0.1mol/L的Na2CO3溶液中含有OH-离子数为0.1NA | |
| C. | 常温常压下,28gN2、CO的混合气体中含有N2分子数为0.5NA | |
| D. | 标准状况下,22.4LCl2与足量NaOH溶液反应,转移的电子数为2NA |
14.对于常温常压下的22.4LSO2,下列有关说法正确的是( )(NA表示阿伏加德罗常数)
| A. | 物质的量为1mol | B. | 质量大于64g | ||
| C. | 含S原子数目大于NA | D. | 含O原子的物质的量小于2mol |
3.环保部门的技术人员常用草酸(H2C2O4)测定酸性工业废水中MnO4-的浓度.某课题组研究发现:少量的摩尔氏盐[FeSO4?(NH4)2SO4?6H2O]可加快溶液紫红色的褪去.为进一步研究有关因素对该反应速率的影响,探究如下:
请回答下列问题:
(1)请完成以下表格(表中不要留有空格):
(2)请写出酸性KMnO4溶液与草酸反应生成CO2的离子方程式:2MnO4-+5H2C2O4+6H+═2Mn2++8H2O+10CO2↑
2MnO4-+5H2C2O4+6H+═2Mn2++8H2O+10CO2↑.
(3)某课题组对摩尔氏盐[FeSO4?(NH4)2SO4?6H2O]中起加快溶液紫红色褪去的成分提出如下假设,请你完成假设二、假设三:
假设一:SO42- 起催化作用.;
假设二:Fe2+起还原作用或起催化作用;
假设三:NH4+起还原作用或起催化作用.
(4)请你设计实验验证上述假设一是否成立,完成下表中的内容.
请回答下列问题:
(1)请完成以下表格(表中不要留有空格):
| 实验编号 | 实验目的 | 温度 | 废水样品 | 2.0mLH2C2O4的浓度 |
| ① | 为以下实验作参照 | 273K | 4.0mL | 0.10mol?L-1 |
| ② | 298K | 4.0mL | 0.10mol?L-1 | |
| ③ | 探究浓度对反应速率的影响 | 273K | 0.20mol?L-1 |
2MnO4-+5H2C2O4+6H+═2Mn2++8H2O+10CO2↑.
(3)某课题组对摩尔氏盐[FeSO4?(NH4)2SO4?6H2O]中起加快溶液紫红色褪去的成分提出如下假设,请你完成假设二、假设三:
假设一:SO42- 起催化作用.;
假设二:Fe2+起还原作用或起催化作用;
假设三:NH4+起还原作用或起催化作用.
(4)请你设计实验验证上述假设一是否成立,完成下表中的内容.
| 实验方案(不要求写具体操作过程) | 预期的实验现象和结论 |
| 取等量的废水样品于两支试管中,… |
13.已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生.若再加入双氧水,将发生反应:H2O2+2H++2I-→2H2O+I2,且生成的I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成的I2完全消耗.由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝.因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-→2H2O+I2的反应速率.
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条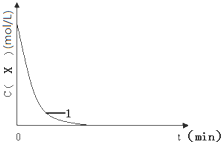 件下进行):
件下进行):
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响.实验2中m=20.0,n=20.0.
(2)已知,I2与X反应时,两者物质的量之比为1:2.按面表格中的X和KI的加入量,加入V(H2O2)>0.5mL,才确保看到蓝色.
(3)实验1,浓度c(X)~t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~t的变化曲线图(进行相应的标注).
(4)实验3表明:硫酸铁能提高反应速率.催化剂能加快反应速率是因为催化剂降低(填“提高”或“降低”)了反应活化能.
(5)环境友好型铝-碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)$?_{充电}^{放电}$2AlI3(s).含I-传导有机晶体合成物作为电解质,该电池负极的电极反应为:Al-3e-+3I-=AlI3,充电时Al连接电源的负极.
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条
 件下进行):
件下进行):| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol•Lˉ1 KI溶液 | H2O | 0.01 mol•Lˉ1 X 溶液 | 0.1 mol•Lˉ1 双氧水 | 1 mol•Lˉ1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(2)已知,I2与X反应时,两者物质的量之比为1:2.按面表格中的X和KI的加入量,加入V(H2O2)>0.5mL,才确保看到蓝色.
(3)实验1,浓度c(X)~t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~t的变化曲线图(进行相应的标注).
(4)实验3表明:硫酸铁能提高反应速率.催化剂能加快反应速率是因为催化剂降低(填“提高”或“降低”)了反应活化能.
(5)环境友好型铝-碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)$?_{充电}^{放电}$2AlI3(s).含I-传导有机晶体合成物作为电解质,该电池负极的电极反应为:Al-3e-+3I-=AlI3,充电时Al连接电源的负极.
18.已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
(3)H2(g)+1/2O2(g)═H2O(l)△H3=-285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓变为( )
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
(3)H2(g)+1/2O2(g)═H2O(l)△H3=-285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓变为( )
| A. | -488.3 kJ/mol | B. | -244.15 kJ/mol | C. | 488.3 kJ/mol | D. | 244.15 kJ/mol |


 ,C:CH3CH2CH2OH,D:
,C:CH3CH2CH2OH,D: ,E:CH3CH=CH2.
,E:CH3CH=CH2. 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,其分子结构和二氧化碳类似.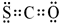 .
.