题目内容
9.用NA表示阿伏加德罗常数的值.下列判断正确的是( )| A. | 32 g O2含有的氧原子数目为2NA | |
| B. | 56 g的Fe在足量Cl2中完全燃烧转移电子数为2NA | |
| C. | 1 mol•L-1 Na2SO4溶液含有的钠离子数目为2NA | |
| D. | 标准状况下,22.4 L苯含有的碳原子数目为6NA |
分析 A、氧气分子由氧原子构成;
B、求出铁的物质的量,然后根据铁和氯气反应后变为+3价来分析;
C、溶液体积不明确;
D、标况下苯为液态.
解答 解:A、氧气分子由氧原子构成,故32g氧气中含有的氧原子的物质的量为n=$\frac{32g}{16g/mol}$=2mol,故含2NA个,故A正确;
B、56g铁的物质的量为1mol,而铁和氯气反应后变为+3价,故1mol铁失去3mol电子即3NA个,故B错误;
C、溶液体积不明确,故溶液中的钠离子的个数无法计算,故C错误;
D、标况下苯为液态,故不能根据气体摩尔体积来计算其物质的量和含有的碳原子的个数,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列说法正确的是( )
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使反应速率增大的主要原因是减小了反应物分子中活化分子的百分数 | |
| D. | 催化剂能增大活化分子的百分数,从而成千上万倍地增大反应速率 |
20.下列物质互为同分异构体的是( )
| A. | 金刚石和石墨 | B. | 1H和2H | C. | 氯化氢和盐酸 | D. | 正丁烷和异丁烷 |
4.下列物质既含有离子键又含共价键的是( )
| A. | NH3 | B. | Na2O | C. | NH4Cl | D. | H2O2 |
14.短周期元素X、Y、Z的原子序数依次增大,Y原子的最外层电子数是次外层的3倍,XY2为红棕色气体,Z的焰色反应呈黄色.下列叙述正确的是( )
| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z) | |
| B. | 气态氢化物的热稳定性:X>Y | |
| C. | 元素X的最高价氧化物对应的水化物是强酸 | |
| D. | 化合物XY、Z2Y、Z2Y2中化学键的类型相同 |
1.某溶液既能溶解Al(OH)3又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、SO42-、Cl-、CO32- | ||
| C. | H+、Mg2+、SO42-、NO3- | D. | Ag+、K+、NO3-、Na+ |
19.工业上用电解NaOH浓溶液的方法制备Na2FeO4,其工作原理如图所示.下列说法正确的是( )
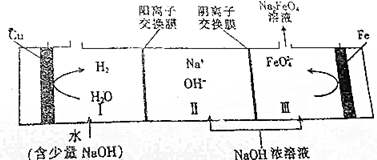

| A. | 电解时,铁棒连接电源的负极 | |
| B. | 铁棒的电极反应式为Fe+6e-+8OH-═FeO42-+4H2O | |
| C. | 若Ⅲ区生成1mol Na2FeO4,Ⅰ区将生成67.2L H2 | |
| D. | 电解总反应的离子方程式为Fe+2OH-+2H2O$\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑ |

 .
. .
.