题目内容
19.工业上用电解NaOH浓溶液的方法制备Na2FeO4,其工作原理如图所示.下列说法正确的是( )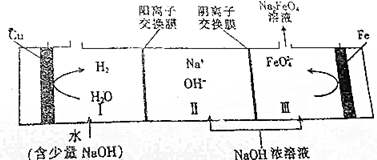
| A. | 电解时,铁棒连接电源的负极 | |
| B. | 铁棒的电极反应式为Fe+6e-+8OH-═FeO42-+4H2O | |
| C. | 若Ⅲ区生成1mol Na2FeO4,Ⅰ区将生成67.2L H2 | |
| D. | 电解总反应的离子方程式为Fe+2OH-+2H2O$\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑ |
分析 由工作原理示意图可知,铁失电子生成高铁酸钠,水获得电子生成氢气,则铁作阳极,Cu作阴极,阳极电极方程式为:Fe-6e-+8OH-═FeO42-+4H2O,阴极电极方程式为2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-,Ⅱ室中钠离子经过阳离子交换膜进入I室,Ⅱ室中OH-离子经过阴离子交换膜进入Ⅲ室.
解答 解:A.由工作原理示意图可知,铁失电子生成高铁酸钠,水获得电子生成氢气,则铁作阳极,Cu作阴极,电解时,铁棒连接电源的正极,故A错误;
B.阳极是铁失电子生成高铁酸钠,阳极电极方程式为:Fe-6e-+8OH-═FeO42-+4H2O,故B正确;
C.阳极电极方程式为:Fe-6e-+8OH-═FeO42-+4H2O,若Ⅲ区生成1mol Na2FeO4,则转移电子为6mol,阴极电极方程式为2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-,可知阴极生成氢气为3mol,但氢气不一定是标况下,故氢气体积不一定是67.2L,故C错误;
D.电解总反应的离子方程式为:Fe+2OH-+2H2O$\frac{\underline{\;电解\;}}{\;}$FeO42-+3H2↑,故D正确,
故选:BD.
点评 本题考查了电解原理,正确判断阴阳极及发生的反应是解本题关键,易错选项是C,注意气体摩尔体积的适用范围和条件.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
9.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 32 g O2含有的氧原子数目为2NA | |
| B. | 56 g的Fe在足量Cl2中完全燃烧转移电子数为2NA | |
| C. | 1 mol•L-1 Na2SO4溶液含有的钠离子数目为2NA | |
| D. | 标准状况下,22.4 L苯含有的碳原子数目为6NA |
10.甲、乙、丙、丁、戊分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.(1)甲、丙均能与稀硫酸反应放出气体;(2)乙与丁的硝酸盐反应置换出单质丁;(3)丙与强碱反应放出气体;(4)丙、戊能被浓硫酸钝化.由此判断甲、乙、丙、丁、戊依次为( )
| A. | Al、Cu、Mg、Ag、Fe | B. | Fe、Cu、Al、Ag、Mg | C. | Mg、Ag、Al、Cu、Fe | D. | Mg、Cu、Al、Ag、Fe |
7.分子式为C6H10O3并能使新制Cu(OH)2悬浊液溶解,继续加热会出现砖红色沉淀的有机物有(不含立体异构)( )
| A. | 8种 | B. | 9种 | C. | 12种 | D. | 13种 |
4.W、X、Y、Z为原子序数依次增大的同周期的短周期元素.已知W、Y、Z三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水.下列判断正确的是( )
| A. | W、Y、Z三种元素的最高价氧化物的水化物可能有两种是强碱、一种是强酸 | |
| B. | Z元素在第三周期第ⅥA族 | |
| C. | W、Y、Z三种元素有两种是金属、一种是非金属 | |
| D. | W、X、Y三种元素的单质熔沸点依次降低 |
1.下列有关说法正确的是( )
| A. | 常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度前者比后者大 | |
| B. | 反应Hg(1)+H2SO4(aq)=HgSO4(aq)+H2(g)在常温下不能自发进行,则△H>0 | |
| C. | 将纯水加热至较高温度,K变大、pH变小、呈酸性 | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时增大氮气的浓度,正逆反应速率均增大,平衡正向移动,氢气的转化率提高 |
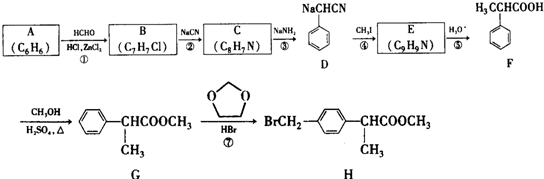
 +HCHO+HCl$\stackrel{ZnCl_{2}}{→}$
+HCHO+HCl$\stackrel{ZnCl_{2}}{→}$ +H2O.
+H2O.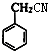 ;E的结构简式为
;E的结构简式为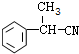 .
. .
.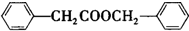 的合成路线
的合成路线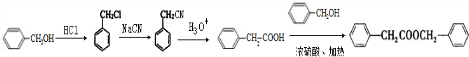 .
. 中和热的测定实验(如图).
中和热的测定实验(如图).