题目内容
17.有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4 ④NaHSO4(a)若四种溶液的物质的量浓度相同,其c(H+)的大小顺序为③>②=④>①
(用序号表示,下同).
(b)若四种溶液的c(H+)相同,其物质的量浓度的大小顺序为①>②═④>③.
分析 (a)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸;
(b)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸,据此分析.
解答 解:(a)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸,若①CH3COOH ②HCl③H2SO4 ④NaHSO4溶液的物质的量浓度相同,c(H+)的大小顺序为:③>②=④>①,
故答案为:③>②=④>①;
(b)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸、硫酸氢钠相当于一元强酸,若①CH3COOH ②HCl③H2SO4 ④NaHSO4溶液的c(H+)相同,则其物质的量浓度大小顺序为:①>②═④>③,
故答案为:①>②═④>③.
点评 本题考查弱电解质的电离,题目难度不大,明确弱电解质的电离特点为解答关键,注意掌握影响电离平衡的因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入4mol•L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50mL,下列说法正确的是( )
| A. | 消耗氧气的体积为1.68 L | |
| B. | 混合气体中含NO21.12 L | |
| C. | 此反应过程中转移的电子为0.3 mol | |
| D. | 参加反应的硝酸是0.4mol |
12.生活、生产中的问题常涉及到化学知识,下列叙述中正确的是( )
| A. | 使用明矾可以对水进行消毒、杀菌 | |
| B. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| C. | 浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 | |
| D. | 信息产业中的光缆的主要成分是单质硅 |
2.下列实验方法或操作正确的是( )
| A. | 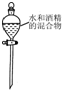 分离水和酒精 | |
| B. |  蒸发NH4Cl溶液得到NH4Cl晶体 | |
| C. | 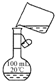 配制一定物质的量浓度溶液时转移溶液 | |
| D. |  除去氯气中的氯化氢 |
9.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 32 g O2含有的氧原子数目为2NA | |
| B. | 56 g的Fe在足量Cl2中完全燃烧转移电子数为2NA | |
| C. | 1 mol•L-1 Na2SO4溶液含有的钠离子数目为2NA | |
| D. | 标准状况下,22.4 L苯含有的碳原子数目为6NA |
6.下列关于物质的量浓度表述正确的是( )
| A. | 0.3 mol•L-1的Na2SO4溶液中含有的Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和S${O}_{4}^{2-}$的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol•L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
7.分子式为C6H10O3并能使新制Cu(OH)2悬浊液溶解,继续加热会出现砖红色沉淀的有机物有(不含立体异构)( )
| A. | 8种 | B. | 9种 | C. | 12种 | D. | 13种 |
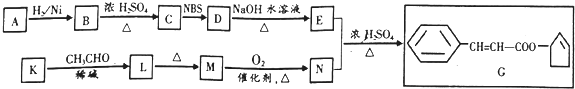
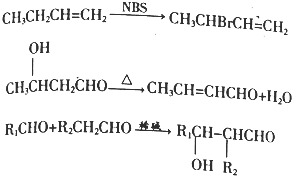
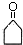
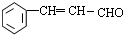 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2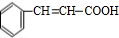
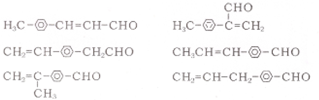 任意一种.
任意一种.