题目内容
4.下列物质既含有离子键又含共价键的是( )| A. | NH3 | B. | Na2O | C. | NH4Cl | D. | H2O2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA族金属、第IIA族金属和第VIA族、第VIIA族元素之间易形成离子键,据此分析解答.
解答 解:A.氨气分子中N-H原子之间只存在共价键,故A错误;
B.氧化钠中钠离子和氧离子之间只存在离子键,故B错误;
C.氯化铵中铵根离子和氯离子之间存在离子键、氨根离子中N-H原子之间存在共价键,故C正确;
D.双氧水分子中H-O、O-O原子之间存在共价键,故D错误;
故选C.
点评 本题考查化学键判断,为高频考点,明确离子键和共价键根本区别是解本题关键,注意不能根据是否判断金属元素判断离子键,易错选项是C.

练习册系列答案
相关题目
14.下列有关物质的性质或应用的说法不正确的是( )
| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 误服重金属盐,立即服用牛奶或豆浆可解毒 | |
| C. | 油脂、乙酸乙酯都属于酯类,但不是同系物 | |
| D. | 蔗糖、淀粉、纤维素水解的最终产物都只是葡萄糖 |
12.生活、生产中的问题常涉及到化学知识,下列叙述中正确的是( )
| A. | 使用明矾可以对水进行消毒、杀菌 | |
| B. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| C. | 浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 | |
| D. | 信息产业中的光缆的主要成分是单质硅 |
19.CO2是一种温室气体.CO2属于( )
| A. | 酸 | B. | 碱 | C. | 有机物 | D. | 酸性氧化物 |
9.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 32 g O2含有的氧原子数目为2NA | |
| B. | 56 g的Fe在足量Cl2中完全燃烧转移电子数为2NA | |
| C. | 1 mol•L-1 Na2SO4溶液含有的钠离子数目为2NA | |
| D. | 标准状况下,22.4 L苯含有的碳原子数目为6NA |

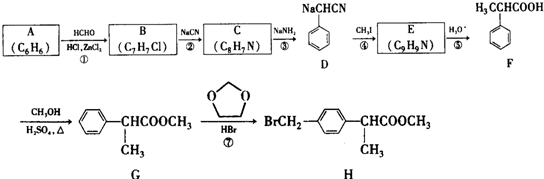
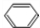 +HCHO+HCl$\stackrel{ZnCl_{2}}{→}$
+HCHO+HCl$\stackrel{ZnCl_{2}}{→}$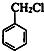 +H2O.
+H2O. ;E的结构简式为
;E的结构简式为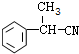 .
. .
.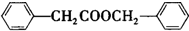 的合成路线
的合成路线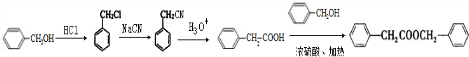 .
.