题目内容
实验中的下列操作正确的是( )
| A、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 |
| B、Ba(NO3)2 溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后应冷却至室温再转移到容量瓶中 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.量取溶液时,如果量取溶液过多,不能将多余的药品倒回原瓶;
B.钡元素属于重金属,不能随便丢弃;
C.蒸发氯化钠溶液制取NaCl固体时,不能将溶液全部加热蒸干;
D.配制一定物质的量浓度稀硫酸时,浓硫酸溶于水后应冷却至室温再转移到容量瓶中,否则会产生误差.
B.钡元素属于重金属,不能随便丢弃;
C.蒸发氯化钠溶液制取NaCl固体时,不能将溶液全部加热蒸干;
D.配制一定物质的量浓度稀硫酸时,浓硫酸溶于水后应冷却至室温再转移到容量瓶中,否则会产生误差.
解答:
解:A.量取溶液时,如果量取溶液过多,不能将多余的药品倒回原瓶,否则会污染药品,应该集中回收,故A错误;
B.钡元素属于重金属,不能随便丢弃,倒入下水道会污染土壤、水资源,应该集中回收,故B错误;
C.蒸发氯化钠溶液制取NaCl固体时,不能将溶液全部加热蒸干,有少量液体时停止加热,利用余温将水分蒸干,故C错误;
D.配制一定物质的量浓度稀硫酸时,浓硫酸稀释时放热导致溶液温度升高,溶液有热胀冷缩性质,如果直接转移到容量瓶中会导致配制溶液体积偏小,配制溶液浓度偏高,所以浓硫酸溶于水后应冷却至室温再转移到容量瓶中,故D正确;
故选D.
B.钡元素属于重金属,不能随便丢弃,倒入下水道会污染土壤、水资源,应该集中回收,故B错误;
C.蒸发氯化钠溶液制取NaCl固体时,不能将溶液全部加热蒸干,有少量液体时停止加热,利用余温将水分蒸干,故C错误;
D.配制一定物质的量浓度稀硫酸时,浓硫酸稀释时放热导致溶液温度升高,溶液有热胀冷缩性质,如果直接转移到容量瓶中会导致配制溶液体积偏小,配制溶液浓度偏高,所以浓硫酸溶于水后应冷却至室温再转移到容量瓶中,故D正确;
故选D.
点评:本题考查化学实验方案评价,涉及药品的取用、实验操作、溶液的配制等知识点,知道实验原理是解本题关键,会分析配制溶液时产生的误差,题目难度不大.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
铁丝、铜片在氯气中燃烧的烟的颜色分别为( )
| A、棕黄、棕红 |
| B、棕黄、苍白 |
| C、棕红、苍白 |
| D、棕红、棕黄 |
某溶液中只含有K+、Na+、NO3-、SO42-四种离子(不考虑水的电离)它们的物质的量之比为1:6:3:2,该溶液所含的溶质可能是( )
| A、KNO3、Na2SO4 |
| B、K2SO4、NaNO3、KNO3 |
| C、KNO3、Na2SO4、NaNO3 |
| D、K2SO4、Na2SO4、KNO3 |
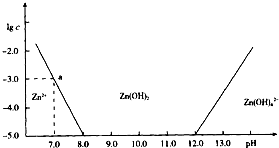 已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.
已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.
