题目内容
已知常温下,FeS的KSP=625×10-18(mol?L-1)2,ZnS的KSP=1.2×10-23(mol?L-1)2,H2S的饱和溶液中c2(H+)?c(S2-)=1.0×10-22.试回答下列问题:
(1)在ZnS的饱和溶液中:①加入少量固体Na2S,则溶液中c(S2-) (填”变大”“变小”或”
不变”,下同);②加入ZnS固体,则溶液中c(S2-) ;③加入FeS固体,则溶液中c(Zn2+) .
(2)在常温下,将适量的FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.01mol?L-1,应调节pH= (已知lg2=0.3).
(1)在ZnS的饱和溶液中:①加入少量固体Na2S,则溶液中c(S2-)
不变”,下同);②加入ZnS固体,则溶液中c(S2-)
(2)在常温下,将适量的FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到0.01mol?L-1,应调节pH=
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:(1)根据平衡移动的影响因素,增大生成物浓度,平衡向左移动,加入固体物质,不改变各组分的浓度,据此分析解答;
(2)根据硫化亚铁的溶度积常数和亚铁离子浓度计算硫离子浓度,再根据氢硫酸的电离平衡常数计算氢离子浓度,最后利用pH计算公式计算溶液的pH.
(2)根据硫化亚铁的溶度积常数和亚铁离子浓度计算硫离子浓度,再根据氢硫酸的电离平衡常数计算氢离子浓度,最后利用pH计算公式计算溶液的pH.
解答:
解:(1)①ZnS溶液中存在着ZnS(s)?Zn2+(aq)+S2-(aq),硫化钠为强电解质,当加入Na2S固体时,硫化钠电离出的硫离子,增大生成物浓度,平衡左移,所以抑制硫化锌的电离,溶液中c(S2-)增大,故答案为:变大;
②加入ZnS固体,未改变溶液中各种离子的浓度,故溶液中c(S2-)不变,故答案为:不变;
③加入FeS固体,依据FeS的KSP=625×10-18(mol?L-1)2,ZnS的KSP=1.2×10-23(mol?L-1)2,即硫化锌的溶解度小于硫化亚铁,即c(S2-)增大,故沉淀平衡左移,即溶液中c(Zn2+)变小,故答案为:变小;
(2)将适量FeS 投入H2S 饱和溶液中,c(Fe2+)达到0.01mol/L,溶液中c(S2-)=
=
mol/L=6.25×10-16mol/L,c2(H+)?c(S2-)=1.0×10-22,则c(H+)=
mol/L=4×10-4mol/L,pH=-lg4×10-4=3.4,
故答案为:3.4.
②加入ZnS固体,未改变溶液中各种离子的浓度,故溶液中c(S2-)不变,故答案为:不变;
③加入FeS固体,依据FeS的KSP=625×10-18(mol?L-1)2,ZnS的KSP=1.2×10-23(mol?L-1)2,即硫化锌的溶解度小于硫化亚铁,即c(S2-)增大,故沉淀平衡左移,即溶液中c(Zn2+)变小,故答案为:变小;
(2)将适量FeS 投入H2S 饱和溶液中,c(Fe2+)达到0.01mol/L,溶液中c(S2-)=
| Ksp |
| c(Fe2+) |
| 6.25×10-18 |
| 0.01 |
|
故答案为:3.4.
点评:本题考查难溶电解质的溶解平衡、影响平衡移动的因素、PH计算,根据溶度积常数及弱酸的电离平衡常数进行溶液的pH计算是解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列变化不能用勒夏特列原理解释的是( )
| A、工业合成氨的反应,往往需要使用催化剂 |
| B、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| C、Fe(SCN)3溶液中加入少量固体KSCN后颜色变深 |
| D、实验室用排饱和食盐水的方法收集氯气 |
下列说法中,正确的是( )
| A、两种难溶盐电解质,其中Ksp小的溶解度一定小 |
| B、溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先沉淀 |
| C、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
| D、凡是能自发进行的化学反应,一定是△H<0、△S>0 |
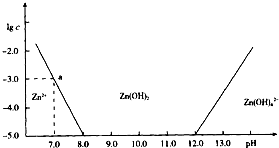 已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.
已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.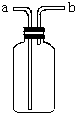 如图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其他用途:
如图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其他用途: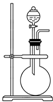 如图是实验室制取某些气体的装置.
如图是实验室制取某些气体的装置.
