题目内容
如图1为实验室制备、收集少量HCl的装置.
①制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用图2中的 .

②请解释能用浓硫酸和浓盐酸制备HCl气体的原因 .
③装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和 .
①制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用图2中的

②请解释能用浓硫酸和浓盐酸制备HCl气体的原因
③装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和
考点:实验装置综合,常见气体制备原理及装置选择
专题:实验题
分析:①浓硫酸和浓盐酸混合放出大量的热,促进盐酸挥发;
②根据浓硫酸稀释放热与HCl的挥发性分析;
③四氯化碳的密度比水大,而且HCl难溶于四氯化碳,据此分析.
②根据浓硫酸稀释放热与HCl的挥发性分析;
③四氯化碳的密度比水大,而且HCl难溶于四氯化碳,据此分析.
解答:
解:①浓硫酸和浓盐酸混合会挥发出大量HCl,该过程不需要加热,所以选择装置c,故答案为:c;
②浓硫酸具有强吸水性,与浓盐酸混合时会吸收浓盐酸中的水,同时放出大量的热,由于HCl易挥发,硫酸放热促进了HCl气体的挥发,所以可以用浓硫酸和浓盐酸制备HCl气体,
故答案为:浓硫酸具有强吸水性,吸收了浓盐酸中的水,同时放出大量的热,促进了HCl气体的挥发,所以可以用浓硫酸和浓盐酸制备HCl气体;
③四氯化碳的密度比水大,而且HCl难溶于四氯化碳,所以装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和CCl4,故答案为:CCl4.
②浓硫酸具有强吸水性,与浓盐酸混合时会吸收浓盐酸中的水,同时放出大量的热,由于HCl易挥发,硫酸放热促进了HCl气体的挥发,所以可以用浓硫酸和浓盐酸制备HCl气体,
故答案为:浓硫酸具有强吸水性,吸收了浓盐酸中的水,同时放出大量的热,促进了HCl气体的挥发,所以可以用浓硫酸和浓盐酸制备HCl气体;
③四氯化碳的密度比水大,而且HCl难溶于四氯化碳,所以装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和CCl4,故答案为:CCl4.
点评:本题考查了物质的制备、分离和提纯,为高频考点,侧重于基本实验操作的考查,题目难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
检验试样中某离子的操作及结论合理的是( )
| A、先加BaCl2溶液有白色沉淀,再加稀HNO3溶液不溶解,则试样中一定有SO42- |
| B、加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,则试样中一定有CO32- |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则试样中一定有NH4+ |
| D、透过蓝色钴玻璃观察到焰色为紫色,则试样中一定有钾元素、没有钠元素 |
下列说法中,正确的是( )
| A、两种难溶盐电解质,其中Ksp小的溶解度一定小 |
| B、溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先沉淀 |
| C、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
| D、凡是能自发进行的化学反应,一定是△H<0、△S>0 |
铁丝、铜片在氯气中燃烧的烟的颜色分别为( )
| A、棕黄、棕红 |
| B、棕黄、苍白 |
| C、棕红、苍白 |
| D、棕红、棕黄 |
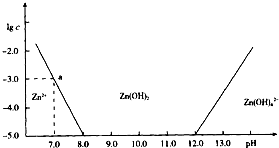 已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.
已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.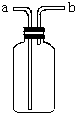 如图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其他用途:
如图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其他用途: