题目内容
14.下列物质属于弱电解质的是( )| A. | CO2 | B. | NH3•H2O | C. | HCl | D. | AgNO3 |
分析 在水溶液中完全电离的电解质为强电解质,在水溶液中部分电离的电解质为弱电解质,可见强弱电解质的根本区别为在溶液中能够完全电离,据此进行解答.
解答 解:A.CO2在水溶液中或熔融状态下不导电,为非电解质,故A错误;
B.NH3•H2O在水溶液中只能部分电离出铵根离子和氢氧根离子,则NH3•H2O为弱电解质,故B正确;
C.HCl在水溶液中完全电离出氯离子和氢离子,所以HCl为强电解质,故C错误;
D.AgNO3在水溶液中完全电离,属于强电解质,故D错误;
故选B.
点评 本题考查了电解质与非电解质、强电解质与弱电解质的判断,题目难度不大,注意明确电解质与非电解质、强电解质与弱电解质的概念及区别,明确单质和混合物不属于电解质、非电解质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.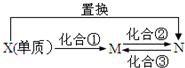 M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )
M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )
 M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )
M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )| A. | X可以是Mg或Cu元素 | |
| B. | 化合②③的反应可以是非氧化还原反应 | |
| C. | 若X为C元素,则该转化关系中X单质发生的置换反应可以是2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO | |
| D. | 若X为Fe元素,则M的H218O溶液中加入固体Na2O2的反应为:4Fe3++6H218O+6Na2O2═4Fe(OH)3↓+12Na++318O2↑ |
9.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O$?_{充电}^{放电}$Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
| A. | 放电时负极得电子,质量减轻 | |
| B. | 放电时电解质溶液中的OH-向正极移动 | |
| C. | 充电时阴极附近溶液的pH减小 | |
| D. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O |
19.从樟科植物枝叶提取的精油中含有如图1甲、乙及如表三种成分:
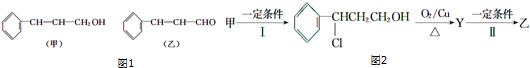
(1)甲中含氧官能团的名称为碳碳双键、醇羟基.
(2)由甲转化为乙需经如图2过程(已略去各步反应的无关产物,下同):其中反应Ⅰ的反应类型为加成,反应Ⅱ的化学方程式为 .
.

| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
(2)由甲转化为乙需经如图2过程(已略去各步反应的无关产物,下同):其中反应Ⅰ的反应类型为加成,反应Ⅱ的化学方程式为
 .
.
3.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加C的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入一定量的H2O(g) | |
| D. | 保持压强不变,充入N2使容器体积变大 |
4.在元素周期表中,周期的划分依据是( )
| A. | 元素原子的核电荷数 | B. | 元素的化合价 | ||
| C. | 元素原子的电子层数 | D. | 元素原子的最外层电子数 |
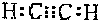 .
.