题目内容
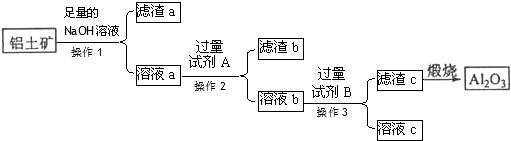
12.实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
步骤1:向废液中加入足量的NaCl溶液,将所得沉淀过滤,并洗涤干净.
步骤2:将沉淀放入烧杯,并放入铝片,再加入20%的Na2CO3溶液至浸没固体,加热搅拌,至沉淀变为灰白色[含有Ag、Al(OH)3和少量仍未反应的AgCl].取出铝片,过滤并洗涤沉淀.
步骤3:…
(1)步骤1中检验所加NaCl溶液已经足量的方法是静置,向上层清液中继续滴加NaCl溶液,若溶液不变浑浊,则NaCl已足量.
(2)步骤2加热时还产生能使澄清石灰水变浑浊的气体.写出该过程中发生反应的离子方程式:2Al+6AgCl+3CO3 2-+3H2O=2Al(OH)3+6Ag+6Cl-+3CO2↑.
(3)已知AgNO3和Al(NO3)3的溶解度曲线如图所示,请补充完整由步骤2中所得灰白色沉淀制取硝酸银晶体的实验方案:向所得灰白色混合物中加入足量稀盐酸,充分反应后,过滤;洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤;将所得滤液蒸发浓缩、冷却结晶,过滤;用冰水洗涤、干燥,得到硝酸银晶体(实验中必须使用的试剂有:稀盐酸、稀硝酸、冰水).
(4)已知:Ag++SCN-═AgSCN↓(白色).实验室可通过如下过程测定所制硝酸银样品的纯度(杂质不参与反应):
①称取2.000g制备的需要样品,加水溶解,定容到100mL溶液配制过程中所用的玻璃仪器除烧杯、玻璃棒外还有100mL容量瓶、胶头滴管.
②准确量取25.00mL溶液,酸化后滴入几滴铁铵矾[NH4Fe(SO4)2]溶液作指示剂,再用0.1000mol•L-1NH4SCN标准溶液滴定.滴定终点的实验现象为溶液变为(血)红色.
③重复②的操作两次,所用NH4SCN标准溶液的平均体积为29.00mL.则硝酸银的质量分数为98.60%.
分析 (1)步骤1中向上清液中继续加NaCl溶液看是否有沉淀,可判断所加氯化钠是否足量;
(2)步骤2加热时产生的能使澄清石灰水变浑浊的气体为二氧化碳,反应生成了Ag、Al(OH)3,由电荷守恒可知应生成NaCl,根据元素守恒应有水参加反应,结合原子守恒和电荷守恒书写;
(3)硝酸银溶解度随温度升高而增大且受温度影响比较大,而硝酸铝溶解度受温度影响不大,可向沉淀中加入足量稀盐酸,过滤,向沉淀中加入足量稀硝酸,充分反应后,过滤,将所得滤液蒸发浓缩、冷却结晶,过滤、洗涤、干燥,可得硝酸银固体;
(4)①配制100mL一定物质的量浓度的溶液,所需要的玻璃离仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管;
②用 NH4SCN标准溶液滴定硝酸银溶液,滴定终点时,SCN-与铁离子结合生成血红色溶液;
③计算消耗NH4SCN的物质的量,根据Ag++SCN-=AgSCN↓可求得硝酸银的质量,进而确定质量分数.
解答 解:(1)步骤1中检验所加NaCl溶液已经足量的方法是:静置,向上层清液中继续滴加NaCl溶液,若溶液不变浑浊,则NaCl已足量,
故答案为:静置,向上层清液中继续滴加NaCl溶液,若溶液不变浑浊,则NaCl已足量;
(2)步骤2加热时产生的能使澄清石灰水变浑浊的气体为二氧化碳,反应生成了Ag、Al(OH)3,由电荷守恒可知应生成NaCl,根据元素守恒应有水参加反应,反应离子方程式为:2Al+6AgCl+3CO3 2-+3H2O=2Al(OH)3+6Ag+6Cl-+3CO2↑,
故答案为:2Al+6AgCl+3CO3 2-+3H2O=2Al(OH)3+6Ag+6Cl-+3CO2↑;
(3)步骤2中所得灰白色沉淀主要含有Ag、Al(OH)3和少量仍未反应的AgCl,可向沉淀中加入足量稀盐酸,充分反应后,过滤,洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤,将所得滤液蒸发浓缩、冷却结晶,过滤、洗涤、干燥,可得硝酸银固体,
故答案为:加入足量稀盐酸,充分反应后,过滤;洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤;将所得滤液蒸发浓缩、冷却结晶,过滤;用冰水洗涤、干燥;
(4)①配制100mL一定物质的量浓度的溶液,所需要的玻璃离仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
②用 NH4SCN标准溶液滴定硝酸银溶液,滴定终点时,SCN-与铁离子结合生成血红色溶液,所以滴定终点的实验现象为:溶液变为(血)红色,
故答案为:溶液变为(血)红色;
③NH4SCN标准溶液的平均体积为29.00mL,则NH4SCN的物质的量为0.1000mol•L-1×0.029L=2.9×10-3 mol,根据Ag++SCN-=AgSCN↓可知硝酸银的质量为2.9×10-3 mol×170g/mol×$\frac{100mL}{25mL}$=1.972g,所以硝酸银的质量分数为$\frac{1.972g}{2.000g}$×100%=98.60%,
故答案为:98.60%.
点评 本题考查制备实验方案的设计,涉及氧化还原反应、物质的分离提纯、物质含量测定、沉淀滴定原理应用等,综合性较强,基本属于拼合型题目,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | C元素的相对分子质量是12,则1mol C的质量为12g/mol | |
| B. | 1mol Cl2的体积为22.4L | |
| C. | 1mol CO2中含有3个原子 | |
| D. | 已知NaOH溶液的物质的量浓度为0.5mol/L,则2L该溶液中含NaOH 1mol |
| A. | Cu(NO3)2的物质的量为0.01mol | B. | 通入Cl2的体积(标准状况)为448mL | ||
| C. | 放出H2的体积(标准状况)为112mL | D. | 得到不溶固体的质量为6.72g |
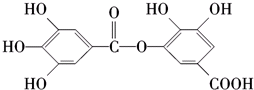
| A. | 常温下 可以和Na2CO3溶液反应生成CO2气体 | |
| B. | 在碱性条件下水解,0.5 mol 该物质完全反应可以消耗4 mol NaOH | |
| C. | 与稀H2SO4共热生成两种不同的有机物 | |
| D. | 该物质的化学式为C14H10O9 |

| A. | 4种 | B. | 5种 | C. | 7种 | D. | 8种 |
| A. | 铅蓄电池工作时转移电子数为2NA时,负极材料质量减少207g | |
| B. | 1molC5H12分子中碳碳之间共用的电子对数为5NA | |
| C. | 电解Na2SO4溶液,在阴极区增加2molH+ 时消耗电子数为2NA | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol,放出46kJ热量转移电子数3NA |
 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H20).
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H20).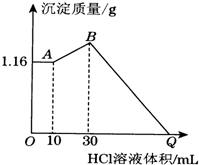 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答: