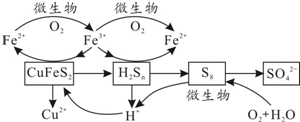
题目内容
17.将FeO与Cu(NO3)2的混合物9.08g全部溶于300mL、1mol/L的盐酸中,有部分Fe2+被酸性条件下的NO3-氧化(其化学反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O),放出NO气体448mL(标准状况);继续向溶液中通入一定量的Cl2恰好将溶液中的Fe2+完全氧化;再加入10g过量的铁粉,充分反应放出H2,过滤,得到不溶固体.下列叙述不正确的是( )| A. | Cu(NO3)2的物质的量为0.01mol | B. | 通入Cl2的体积(标准状况)为448mL | ||
| C. | 放出H2的体积(标准状况)为112mL | D. | 得到不溶固体的质量为6.72g |
分析 A.n(NO)=$\frac{V}{Vm}$=$\frac{0.448L}{22.4L/mol}$=0.02mol,由氮元素守恒计算硝酸铜物质的量;
B.由m=nM计算硝酸铜质量,进而计算FeO的质量,由n=$\frac{m}{M}$计算FeO的物质的量,根据电子转移守恒计算通入氯气物质的量,根据V=nVm计算氯气体积;
C.由NO的物质的量,根据方程式计算消耗HCl物质的量,进而计算剩余HCl,根据氢原子守恒计算生成氢气体积;
D.Fe发生反应:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Cu+Fe2++、Fe+2H+=Fe2++H2↑,根据方程式计算参加反应Fe的质量,进而计算剩余Fe的质量,最后不溶固体为Cu与剩余Fe的质量之和.
解答 解:混合物与盐酸反应后的溶液中通入一定量的氯气时,溶液中的Fe2+刚好被完全氧化,再向溶液中加入10g过量的铁粉,充分反应后,有气体产生,说明混合物与盐酸反应时,硝酸根完全反应,且盐酸有剩余,
A.n(NO)=$\frac{V}{Vm}$=$\frac{0.448L}{22.4L/mol}$=0.02mol,由氮元素守恒可知硝酸铜物质的量为$\frac{0.02mol}{2}$=0.01mol,故A正确;
B.硝酸铜质量为0.01mol×188g/mol=1.88g,则氧化亚铁的质量为9.08-1.88g=7.2g,根氧化亚铁物质的量=$\frac{7.2g}{72g/mol}$=0.1mol,令通入氯气为x mol,根据电子转移守恒:0.1×(3-2)=0.02×(5-2)+2x,解得x=0.02mol,故通入氯气的体积为0.02mol×22.4L/mol=0.448L=448mL,故B正确;
C.生成NO的物质的量为0.02mol,根据方程式3FeCl2+HNO3+3HCl═3FeCl3+NO↑+2H2O,可知消耗HCl的物质的量=0.02mol×(3+1)=0.08mol,由FeO+2HCl=FeCl2+H2O可知消耗HCl为0.1mol×2=0.2mol,故共消耗HCl为0.28mol,剩余HCl为0.3mol-0.28mol=0.02mol,根据氢原子守恒,生成氢气的物质的量为$\frac{0.02mol}{2}$=0.01mol,故生成氢气的体积=0.01mol×22.4L/mol=0.224L=224mL,故C错误;
D.由Fe元素守恒可知,溶液中Fe3+为0.1mol,由Fe+2Fe3+=3Fe2+可知,消耗Fe为$\frac{0.1mol}{2}$=0.05mol,溶液中Cu2+为0.01mol,由Fe+Cu2+=Cu+Fe2+可知,消耗Fe为0.01mol,生成氢气为0.01mol,由Fe+2H+=Fe2++H2↑,可知消耗Fe为0.01mol,故总共消耗Fe的质量=(0.05+0.01+0.01)mol×56g/mol=3.92g,剩余Fe的质量=10g-3.92g=6.08g,最后不溶固体为Cu与剩余Fe的质量之和,故不溶固体质量为6.08g+0.01mol×64g/mol=6.72g,故D正确;
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、电子及原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | .①②②③ | B. | ②③②① | C. | ②①②③ | D. | ①①②③ |
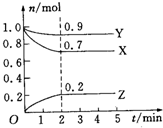 某温度时,在2L密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示,下列说法中不正确的是( )
某温度时,在2L密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示,下列说法中不正确的是( )| A. | 该反应的化学方程式为3X+Y?2Z | |
| B. | 反应到达平衡状态时,X的转化率为70% | |
| C. | 反应开始到2min,Z的平均反应速率为0.05mol•L-1•min-1 | |
| D. | 为提高X的转化率,可适当增加Y的浓度 |
| A. | 乙酸 | B. | 乙烯 | C. | 乙醇 | D. | 苯 |
| A. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 硅与NaOH溶液的反应:Si+2OH-+H2O═SiO32-+2H2↑ | |
| C. | 硫酸与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 氯气溶于水的反应:Cl2+H2O═2H++Cl-+ClO- |