题目内容
7.下列说法正确的是( )| A. | C元素的相对分子质量是12,则1mol C的质量为12g/mol | |
| B. | 1mol Cl2的体积为22.4L | |
| C. | 1mol CO2中含有3个原子 | |
| D. | 已知NaOH溶液的物质的量浓度为0.5mol/L,则2L该溶液中含NaOH 1mol |
分析 A.质量的单位为g;
B.在标准状况下,气体的摩尔体积约为22.4L/mol;
C.N=nNA;
D.根据n=cV计算.
解答 解:A.C元素的相对原子质量是12,则1mol C的质量为12g,故A错误;
B.在标准状况下,气体的摩尔体积约为22.4L/mol,则在标准状况下,1mol Cl2的体积为22.4L,故B错误;
C.1mol CO2中含有3mol原子,则原子数N=nNA=3NA,故C错误;
D.已知NaOH溶液的物质的量浓度为0.5mol/L,则2L该溶液中含NaOHn=cV=0.5mol/L×2L=1mol,故D正确.
故选D.
点评 本题考查了气体摩尔体积、摩尔质量、阿伏伽德罗常数等概念的分析判断以及物质的量的有关计算,掌握物质的量的有关概念和计算方法是关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.下列说法不正确的是( )
| A. | 化学反应中一定有化学键断裂,同时也有化学键形成 | |
| B. | 只含共价键的物质一定是共价化合物 | |
| C. | 离子化合物一定含有离子键,可能含有共价键 | |
| D. | 金属元素和非金属元素形成的化合物不一定是离子化合物 |
15.X、Y、Z、R均为短周期元素,X、Y、R同周期,其中R的质子数最大;X、Z同主族.X的原子结构示意图为: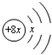 ,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )
,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )
 ,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )
,Y的原子半径在短周期中最大,Y与R最外层电子数之比为1:7.下列叙述正确的是( )| A. | 对应氢化物的沸点:R>Z>X | |
| B. | Y、Z形成的化合物中只有离子键 | |
| C. | 离子半径:X>Z>Y | |
| D. | Z与X、Y与R形成化合物的晶体类型相同 |
2.新型净水剂高铁酸钠(Na2FeO4)可通过以下反应制备:Fe2O3+3Na2O2$\frac{\underline{\;熔融\;}}{\;}$2Na2FeO4+Na2O,下列说法正确的是( )
| A. | 在Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 | |
| B. | Na2O2既是氧化剂又是还原剂 | |
| C. | Na2FeO4既是氧化产物又是还原产物 | |
| D. | 3mol Na2O2发生反应,有12mol电子转移 |
19.下列化学变化中属于取代反应的有( )
①光照甲烷与氯气的混合气体
②由乙烯制乙醇
③乙烯使溴水褪色
④乙烯使酸性高锰酸钾褪色
⑤乙醇与乙酸的酯化反应
⑥苯与液溴在FeBr3催化下反应
⑦苯的硝化反应
⑧由乙烯制备聚乙烯.
①光照甲烷与氯气的混合气体
②由乙烯制乙醇
③乙烯使溴水褪色
④乙烯使酸性高锰酸钾褪色
⑤乙醇与乙酸的酯化反应
⑥苯与液溴在FeBr3催化下反应
⑦苯的硝化反应
⑧由乙烯制备聚乙烯.
| A. | ①⑤⑥⑦ | B. | ①③④⑦⑧ | C. | ②③④⑤⑥⑦ | D. | ①②③④⑤⑥⑦ |
16.下列反应中属于加成反应的是( )
| A. | CH2=CH2+HCl→CH3CH2Cl | B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 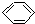 +HO-NO2 $→_{60℃}^{浓硫酸}$ +HO-NO2 $→_{60℃}^{浓硫酸}$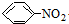 +H2O +H2O |
17.在密闭容器中加入2.0mol SO2和1.0mol O2,一定条件下发生如下反应2SO2+O2?2SO3.反应达到平衡后,各物质的物质的量可能为( )
| n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
| A | 1.0 | 0 | 1.0 |
| B | 0 | 0 | 2.0 |
| C | 0.2 | 0.1 | 1.8 |
| D | 1.5 | 0.75 | 1.0 |
| A. | A | B. | B | C. | C | D. | D |
