题目内容
2.阿伏伽德罗常数用NA表示,下列说法正确的是( )| A. | 铅蓄电池工作时转移电子数为2NA时,负极材料质量减少207g | |
| B. | 1molC5H12分子中碳碳之间共用的电子对数为5NA | |
| C. | 电解Na2SO4溶液,在阴极区增加2molH+ 时消耗电子数为2NA | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol,放出46kJ热量转移电子数3NA |
分析 A.根据Pb+SO42--2e-=PbSO4,负极质量增加;
B.1个C5H12分子中含有12个C-H,4个C-C;
C.阴极区氢离子放电生成氢气;
D.依据N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol可知,放出92KJ热量,转移6mol电子.
解答 解:A.铅蓄电池工作时转移电子数为2NA时,根据Pb+SO42--2e-=PbSO4,负极质量增加,增加的质量为硫酸根离子的质量,每通过2mol电子负极质量增加96g,故A错误;
B.1molC5H12分子中碳碳之间共用4molC-C键,含有共用电子对数为4NA,故B错误;
C.阴极区氢离子放电生成氢气,氢离子减少,故C错误;
D.依据N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol可知,放出92KJ热量,转移6mol电子,则放出46kJ热量转移电子数3NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的应用,侧重考查,有机物结构特点,电解池、原电池工作原理,热化学方程式含义的考查,题目难度中等,解题关键在于明确电解池、原电池工作原理,题目难度中等.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
17.在密闭容器中加入2.0mol SO2和1.0mol O2,一定条件下发生如下反应2SO2+O2?2SO3.反应达到平衡后,各物质的物质的量可能为( )
| n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
| A | 1.0 | 0 | 1.0 |
| B | 0 | 0 | 2.0 |
| C | 0.2 | 0.1 | 1.8 |
| D | 1.5 | 0.75 | 1.0 |
| A. | A | B. | B | C. | C | D. | D |
7.下列离子方程式书写正确的是( )
| A. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 硅与NaOH溶液的反应:Si+2OH-+H2O═SiO32-+2H2↑ | |
| C. | 硫酸与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 氯气溶于水的反应:Cl2+H2O═2H++Cl-+ClO- |
14.下列有关化学用语的表示正确的是( )
| A. | 氯分子的电子式: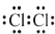 | B. | 氯离子(Cl-)的结构示意图: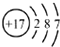 | ||
| C. | 中子数为20的氯原子: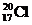 | D. | 氯乙烯分子的结构简式:H3C-CH2Cl |


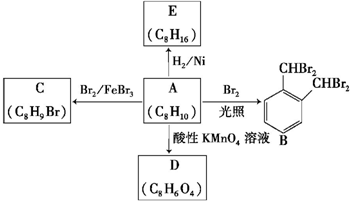 芳香族化合物A是一种基本化工原料,可以从煤和石油中得到.A、B、C、D、E的转化关系如图所示,已知:
芳香族化合物A是一种基本化工原料,可以从煤和石油中得到.A、B、C、D、E的转化关系如图所示,已知: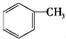 $\stackrel{酸性高锰酸钾}{→}$
$\stackrel{酸性高锰酸钾}{→}$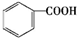
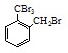 .
.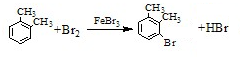 .
.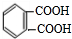 .
.