题目内容
18.下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )| A. | 任何条件下,16gCH4与18 g H2O所含有电子数均为10NA | |
| B. | 19g的H3O+离子中含有的电子数为11NA | |
| C. | 0.5mol/LH2SO4中的H+数为NA | |
| D. | 22.4 L的CO气体与1 mol N2所含的电子数相等 |
分析 A.甲烷和水分子中含有含有10个电子,根据n=$\frac{m}{M}$计算出二者的物质的量,然后计算出含有电子的物质的量及数目;
B.H3O+中含有10个电子,根据n=$\frac{m}{M}$计算出其物质的量,然后计算出含有电子的物质的量及数目;
C.缺少硫酸溶液体积,无法计算含有氢离子的数目;
D.不是标况下,无法计算一氧化碳的物质的量.
解答 解:A.16gCH4与18 g H2O的物质的量都是1mol,1mol二者分子中都含有10mol电子,所含有电子数均为10NA,故A正确;
B.19g的H3O+离子的物质的量为1mol,1mol该离子中含有10mol电子,含有的电子数为10NA,故B错误;
C.没有告诉0.5mol/LH2SO4溶液的体积,无法计算含有氢离子的数目,故C错误;
D.不是标准状况下,不能使用标况下的气体摩尔体积计算,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度不大,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
15.0.25mol Na2SO4中所含的Na+离子数约为( )
| A. | 0.5 | B. | 6.02×1023 | C. | 3.01×1023 | D. | 2 |
16.已知:Fe+Cu2+═Cu+Fe2+和2Fe3++Cu═2Fe2++Cu2+,则下列判断不正确的是( )
| A. | Fe3+、Cu2+、Fe2+氧化性依次减弱 | |
| B. | 可发生反应:Fe+2Fe3+═2Fe2+ | |
| C. | Fe、Fe2+、Cu还原性依次减弱 | |
| D. | 将铁、铜混合粉末放入FeCl3溶液中,铁粉先溶解 |
6.某高中化学实验兴趣小组设计如下实验方案,探究SO2的制备及相关性质实验,实验装置如图所示:
请回答下列问题:
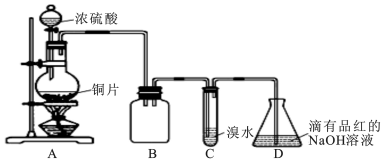
(1)装置B的作用是防倒吸(或安全瓶). 反应过程中圆底烧瓶内的溶液中有一种白色固体析出,为了证明该物质常采用的实验操作及现象为:将溶液冷却后,把反应后的混合物慢慢倒入盛有少量水的另一支试管里观察溶液的颜色,待实验完成、圆底烧瓶冷却后,若固体溶解,溶液变蓝,则白色固体为硫酸铜.
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-;.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3和NaClO恰好反应;Ⅱ.NaClO不足;Ⅲ.NaClO过量
甲同学通过下列实验确定该反应属于哪一种情况,请完成表:
(4)请设计简单实验方案证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kh的相对大小:常温下,用pH试纸(或pH计)测定NaHS03溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb.
请回答下列问题:

(1)装置B的作用是防倒吸(或安全瓶). 反应过程中圆底烧瓶内的溶液中有一种白色固体析出,为了证明该物质常采用的实验操作及现象为:将溶液冷却后,把反应后的混合物慢慢倒入盛有少量水的另一支试管里观察溶液的颜色,待实验完成、圆底烧瓶冷却后,若固体溶解,溶液变蓝,则白色固体为硫酸铜.
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-;.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3和NaClO恰好反应;Ⅱ.NaClO不足;Ⅲ.NaClO过量
甲同学通过下列实验确定该反应属于哪一种情况,请完成表:
| 序号 | 实验操作 | 预期现象及结论 |
| ① | 取上述混合溶液于试管A中,加入少量CaCO3固体,充分振荡. | 若固体溶解,产生气泡,则Ⅰ或Ⅱ成立. |
| ② | 继续向试管A中滴加溴水,充分振荡. | 若溶液褪色,结合步骤①,则Ⅱ成立;若溶液不褪色,结合步骤①,则Ⅰ成立 |
| ③ | 另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡. | 溶液变为蓝色,则Ⅲ成立. |
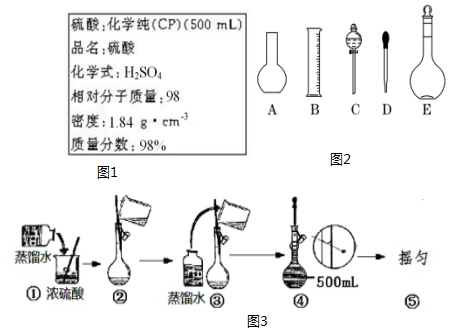
13.实验室要用98%(ρ=1.84g•cm-3)的硫酸配制3.68mol•L-1的硫酸溶液500mL,若其他操作均正确,但出现下列错误操作,所配制的硫酸溶液浓度偏高的是( )
| A. | 将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | |
| B. | 将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外 | |
| C. | 用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切 | |
| D. | 用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切 |
3.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下将铁块放入浓H2SO4中 | 无明显现象发生 | 铁常温下与浓H2SO4不反应 |
| B | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均发生了分解 |
| C | 氯水滴入混有KSCN的FeCl2溶液 | 溶液显红色 | 该氯水不具有漂白性 |
| D | 向溶液Y中先加盐酸酸化,无现象,再加入BaCl2溶液 | 白色沉淀 | Y中一定含SO42- |
| A. | A | B. | B | C. | C | D. | D |
10.下列说法正确的是( )
| A. | 体积相同,浓度都为 0.1 mol•L-1的盐酸和醋酸分别与体积相同 2 mol•L-1的NaOH溶液反应,两者速率相同 | |
| B. | 用锌和稀硫酸反应制取氢气时,加入少量硫酸铜固体会使生成氢气的速率加快 | |
| C. | Mg粉和Al粉分别与0.1 mol•L-1的NaOH溶液反应,Mg粉反应速率快 | |
| D. | 相同温度下,大理石块与大理石粉分别与盐酸反应,大理石块的反应速率慢 |
8.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 | |
| B. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 冰镇的啤酒打开后泛起泡沫 |