题目内容
1.下列反应过程中溶液的导电性有显著变化的是( )| A. | 向NaOH溶液中滴加盐酸至完全中和 | |
| B. | 向Ba(OH)2溶液中滴加盐酸至完全中和 | |
| C. | 向Ba(OH)2溶液中滴加硫酸至完全中和 | |
| D. | 向BaCl2溶液中滴加AgNO3至沉淀完全 |
分析 溶液混合后导电能力变化的大小,关键是看混合后溶液中自由移动的离子浓度的变化,离子浓度减小,导电能力减小,离子浓度增大,导电能力增大,据此分析.
解答 解:A.HCl、NaOH为强电解质,向NaOH溶液中滴加盐酸至完全中和,反应生成NaCl和水,NaCl为强电解质,离子浓度、电荷相同,则导电性基本不变,故A不选;
B.Ba(OH)2、HCl为强电解质,向Ba(OH)2溶液中滴加盐酸至完全中和,反应生成氯化钡和水,氯化钡为强电解质,离子所带电荷的浓度相同,则导电性基本不变,故B不选;
C.Ba(OH)2为强电解质,加入硫酸,反应生成硫酸钡和水,硫酸钡难溶于水,溶液中离子浓度很小,溶液导电性减小,故C选;
D.向BaCl2溶液中滴加AgNO3至沉淀完全,生成氯化银和硝酸钡,溶液中电荷的浓度基本不变,导电性基本不变,故D不选;
故选C.
点评 本题考查溶液的导电性,题目难度不大,明确电解质的强弱、发生的化学反应及溶液中自由移动的离子浓度的变化即可解答

练习册系列答案
相关题目
11.下列各项操作错误的是( )
| A. | 萃取、分液前需对分液漏斗检漏 | |
| B. | 进行分液时,分液漏斗中的下层液体从下端流出,上层液体则从上口倒出 | |
| C. | 为保证分液漏斗内的液体顺利流出,需将分液漏斗上面的塞子打开 | |
| D. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 |
12.下列溶液中有关物质的量浓度关系错误的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+ )+c(M+ )=c(OH- )+c(A- ) | |
| B. | pH 相等的 NaHCO3、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(NaHCO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO- )+2c(OH- )=2c(H+ )+c(CH3COOH) | |
| D. | 0.1mol•L-1 的NaHA溶液,其pH=4:c(HA- )>c(H+ )>c(H2A)>c(A2- ) |
16.已知:Fe+Cu2+═Cu+Fe2+和2Fe3++Cu═2Fe2++Cu2+,则下列判断不正确的是( )
| A. | Fe3+、Cu2+、Fe2+氧化性依次减弱 | |
| B. | 可发生反应:Fe+2Fe3+═2Fe2+ | |
| C. | Fe、Fe2+、Cu还原性依次减弱 | |
| D. | 将铁、铜混合粉末放入FeCl3溶液中,铁粉先溶解 |
6.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | SO2溶于水形成的溶液能导电 | SO2是电解质 |
| B | 白磷为正四面体分子 | 白磷分子中P-P键的键角是109.5° |
| C | 1体积水可以溶解700体积氨气 | 氨是极性分子且由于有氢键的影响 |
| D | HF的沸点高于HCI | H-F的键长比H-CI的键长短 |
| A. | SO2溶于水形成的溶液能导电SO2是电解质 | |
| B. | 白磷为正四面体分子白磷分子中P-P键的键角是109.5° | |
| C. | 1体积水可以溶解700体积氨气氨是极性分子且由于有氢键的影响 | |
| D. | HF的沸点高于HCIH-F的键长比H-CI的键长短 |
6.某高中化学实验兴趣小组设计如下实验方案,探究SO2的制备及相关性质实验,实验装置如图所示:
请回答下列问题:
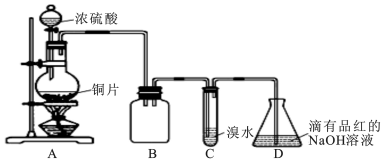
(1)装置B的作用是防倒吸(或安全瓶). 反应过程中圆底烧瓶内的溶液中有一种白色固体析出,为了证明该物质常采用的实验操作及现象为:将溶液冷却后,把反应后的混合物慢慢倒入盛有少量水的另一支试管里观察溶液的颜色,待实验完成、圆底烧瓶冷却后,若固体溶解,溶液变蓝,则白色固体为硫酸铜.
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-;.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3和NaClO恰好反应;Ⅱ.NaClO不足;Ⅲ.NaClO过量
甲同学通过下列实验确定该反应属于哪一种情况,请完成表:
(4)请设计简单实验方案证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kh的相对大小:常温下,用pH试纸(或pH计)测定NaHS03溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb.
请回答下列问题:

(1)装置B的作用是防倒吸(或安全瓶). 反应过程中圆底烧瓶内的溶液中有一种白色固体析出,为了证明该物质常采用的实验操作及现象为:将溶液冷却后,把反应后的混合物慢慢倒入盛有少量水的另一支试管里观察溶液的颜色,待实验完成、圆底烧瓶冷却后,若固体溶解,溶液变蓝,则白色固体为硫酸铜.
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-;.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3和NaClO恰好反应;Ⅱ.NaClO不足;Ⅲ.NaClO过量
甲同学通过下列实验确定该反应属于哪一种情况,请完成表:
| 序号 | 实验操作 | 预期现象及结论 |
| ① | 取上述混合溶液于试管A中,加入少量CaCO3固体,充分振荡. | 若固体溶解,产生气泡,则Ⅰ或Ⅱ成立. |
| ② | 继续向试管A中滴加溴水,充分振荡. | 若溶液褪色,结合步骤①,则Ⅱ成立;若溶液不褪色,结合步骤①,则Ⅰ成立 |
| ③ | 另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡. | 溶液变为蓝色,则Ⅲ成立. |
3.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下将铁块放入浓H2SO4中 | 无明显现象发生 | 铁常温下与浓H2SO4不反应 |
| B | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均发生了分解 |
| C | 氯水滴入混有KSCN的FeCl2溶液 | 溶液显红色 | 该氯水不具有漂白性 |
| D | 向溶液Y中先加盐酸酸化,无现象,再加入BaCl2溶液 | 白色沉淀 | Y中一定含SO42- |
| A. | A | B. | B | C. | C | D. | D |
4.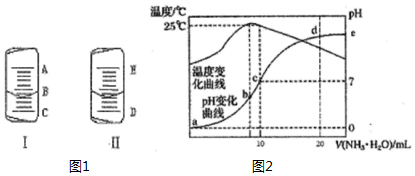 (1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(2)如图1中的图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)D.
A.是amLB.是(50-a)mL C.-定大于amLD.一定大于(50-a)mL
(3)某校化学兴趣小组的同学用0.1000mol•L-1的NaOH标准溶液对一含有少量杂质(杂质不参与反应)的冰醋酸进行测定,回答下列问题:
①用分析天平准确称取该样品2.500g,全部溶于水配制成250mL的溶液,量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,等待测定,该中和滴定中可选用的指示剂是酚酞,滴定终点的现象是当最后一滴NaOH溶液滴入时,待测液由无色变为粉红色,且半分钟内颜色不恢复.
②用0.10mol•L-1的NaOH标准溶液滴定进行滴定,实验数据如表所示,
计算样品中冰醋酸的质量百分含量为72%.
③若读酸式滴定管读数时,滴定前仰视读数,滴定正确读数,则所测结果偏大;
(4)在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如下图所示,回答下列问题:
①a,b,c,d四点所对应的溶液中,水的电离程度由小到大的顺序为a<d<c<b(用“<”连接)
②c点的 c(NH4+ )=0.5mol•L-1
③请结合图2中信息及题目中数据,用含有n的式子列出Kb(NH3•H2O)的表达式(n-1)×10-7.
 (1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.
(1)如图1中的图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为5,量筒中液体的体积是3.6mL.(2)如图1中的图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)D.
A.是amLB.是(50-a)mL C.-定大于amLD.一定大于(50-a)mL
(3)某校化学兴趣小组的同学用0.1000mol•L-1的NaOH标准溶液对一含有少量杂质(杂质不参与反应)的冰醋酸进行测定,回答下列问题:
①用分析天平准确称取该样品2.500g,全部溶于水配制成250mL的溶液,量取其中20.00mL放在锥形瓶中,滴加几滴指示剂,等待测定,该中和滴定中可选用的指示剂是酚酞,滴定终点的现象是当最后一滴NaOH溶液滴入时,待测液由无色变为粉红色,且半分钟内颜色不恢复.
②用0.10mol•L-1的NaOH标准溶液滴定进行滴定,实验数据如表所示,
| 实验编号 | 待测CH3COOH溶液的体积/mL | NaOH溶液的体积/mL |
| 1 | 20.00 | 24.01 |
| 2 | 20.00 | 23.99 |
| 3 | 20.00 | 22.10 |
③若读酸式滴定管读数时,滴定前仰视读数,滴定正确读数,则所测结果偏大;
(4)在某温度时,将n mol•L-1氨水滴入10mL 1.0mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如下图所示,回答下列问题:
①a,b,c,d四点所对应的溶液中,水的电离程度由小到大的顺序为a<d<c<b(用“<”连接)
②c点的 c(NH4+ )=0.5mol•L-1
③请结合图2中信息及题目中数据,用含有n的式子列出Kb(NH3•H2O)的表达式(n-1)×10-7.