题目内容
1.向100mL0.04mol/L的Ca(OH)2溶液中通入CO2气体,当得到0.1g沉淀时,通入CO2的物质的量是( )| A. | 0.014 mol | B. | 0.01 mol | C. | 0.007 mol | D. | 0.005 mol |
分析 向100mL0.04mol/L的Ca(OH)2溶液中通入CO2气体,发生的反应Ca(OH)2+CO2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,反应生成的沉淀0.1g,0.1g的CaCO3是0.001mol,总共Ca2+是0.04mol因此剩馀的Ca2+可能存在在Ca(OH)2中,也有可能存在在Ca(HCO3)2中,结合方程式计算.
解答 解:向100mL0.04mol/L的Ca(OH)2溶液中通入CO2气体,反应生成的沉淀0.1g,0.1g的CaCO3是0.001mol,总共Ca2+是0.03mol因此剩馀的Ca2+可能存在在Ca(OH)2中,也有可能存在在Ca(HCO3)2中
(1)当Ca2+存在于Ca(OH)2和CaCO3时,CO2气体不足,只发送Ca(OH)2+CO2=CaCO3↓+H2O,
CaCO3~CO2
1 1
0.01mol x
x=0.01mol
(2)当Ca2+存在于CaCO3和Ca(HCO3)2时,发生的反应Ca(OH)2+CO2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,
CaCO3~CO2
1 1
0.01mol y1
y1=0.01mol
Ca(HCO3)2~2CO2
1 2
0.03mol y2
y2=0.06mol
y=y1+y2=0.07mol;
故选BC.
点评 本题考查了有关方程式的计算,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握反应中发生的方程式,根据方程式计算.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
18.实验操作正确的是( )
| A. | 将称量NaOH固体时在烧杯中溶解后立即转移到容量瓶中 | |
| B. | 向容量瓶中加水定容时俯视 所配溶液浓度偏高 | |
| C. | 配制NaOH溶液不需用到量筒 | |
| D. | 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线 |
19.在某酸性溶液中,能大量共存的离子组是( )
| A. | Fe2+、K+、C1-、NO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、AlO2- | D. | Ba2+、K+、SO42-、C1- |
16.已知:Fe+Cu2+═Cu+Fe2+和2Fe3++Cu═2Fe2++Cu2+,则下列判断不正确的是( )
| A. | Fe3+、Cu2+、Fe2+氧化性依次减弱 | |
| B. | 可发生反应:Fe+2Fe3+═2Fe2+ | |
| C. | Fe、Fe2+、Cu还原性依次减弱 | |
| D. | 将铁、铜混合粉末放入FeCl3溶液中,铁粉先溶解 |
3.在某稀溶液中含有0.2molHNO3和xmolH2SO4,向其中加入19.2g铜粉,充分反应后产生的气体在标准状况下的体积为4.48L,则x值至少为( )
| A. | 0.6 | B. | 0.4 | C. | 0.3 | D. | 0.2 |
6.某高中化学实验兴趣小组设计如下实验方案,探究SO2的制备及相关性质实验,实验装置如图所示:
请回答下列问题:
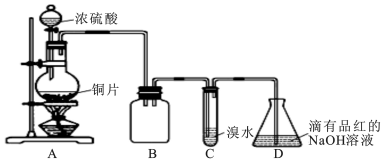
(1)装置B的作用是防倒吸(或安全瓶). 反应过程中圆底烧瓶内的溶液中有一种白色固体析出,为了证明该物质常采用的实验操作及现象为:将溶液冷却后,把反应后的混合物慢慢倒入盛有少量水的另一支试管里观察溶液的颜色,待实验完成、圆底烧瓶冷却后,若固体溶解,溶液变蓝,则白色固体为硫酸铜.
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-;.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3和NaClO恰好反应;Ⅱ.NaClO不足;Ⅲ.NaClO过量
甲同学通过下列实验确定该反应属于哪一种情况,请完成表:
(4)请设计简单实验方案证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kh的相对大小:常温下,用pH试纸(或pH计)测定NaHS03溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb.
请回答下列问题:

(1)装置B的作用是防倒吸(或安全瓶). 反应过程中圆底烧瓶内的溶液中有一种白色固体析出,为了证明该物质常采用的实验操作及现象为:将溶液冷却后,把反应后的混合物慢慢倒入盛有少量水的另一支试管里观察溶液的颜色,待实验完成、圆底烧瓶冷却后,若固体溶解,溶液变蓝,则白色固体为硫酸铜.
(2)设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-;.装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色.
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.NaHSO3和NaClO恰好反应;Ⅱ.NaClO不足;Ⅲ.NaClO过量
甲同学通过下列实验确定该反应属于哪一种情况,请完成表:
| 序号 | 实验操作 | 预期现象及结论 |
| ① | 取上述混合溶液于试管A中,加入少量CaCO3固体,充分振荡. | 若固体溶解,产生气泡,则Ⅰ或Ⅱ成立. |
| ② | 继续向试管A中滴加溴水,充分振荡. | 若溶液褪色,结合步骤①,则Ⅱ成立;若溶液不褪色,结合步骤①,则Ⅰ成立 |
| ③ | 另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡. | 溶液变为蓝色,则Ⅲ成立. |
13.实验室要用98%(ρ=1.84g•cm-3)的硫酸配制3.68mol•L-1的硫酸溶液500mL,若其他操作均正确,但出现下列错误操作,所配制的硫酸溶液浓度偏高的是( )
| A. | 将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | |
| B. | 将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外 | |
| C. | 用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切 | |
| D. | 用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切 |
10.下列说法正确的是( )
| A. | 体积相同,浓度都为 0.1 mol•L-1的盐酸和醋酸分别与体积相同 2 mol•L-1的NaOH溶液反应,两者速率相同 | |
| B. | 用锌和稀硫酸反应制取氢气时,加入少量硫酸铜固体会使生成氢气的速率加快 | |
| C. | Mg粉和Al粉分别与0.1 mol•L-1的NaOH溶液反应,Mg粉反应速率快 | |
| D. | 相同温度下,大理石块与大理石粉分别与盐酸反应,大理石块的反应速率慢 |
11.下列物质不能由单质间直接化合得到的是( )
| A. | FeS | B. | Na2O2 | C. | CuS | D. | Mg3N2 |