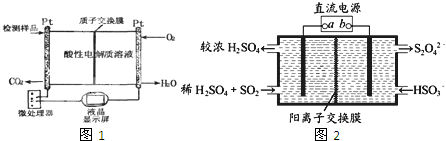
题目内容
室温下,下列各组离子在相应的条件下可能大量共存的是( )
| A、能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ | ||
| B、由水电离产生的c(OH-)=1×10-10 mol?L-1的溶液中:NO3-、Mg2+、Na+、SO42- | ||
C、在
| ||
D、
|
考点:离子共存问题
专题:离子反应专题
分析:A、能使pH试纸变红的溶液是酸性溶液,CO32-不能存在;
B.由水电离产生的c(OH-)=1×10-10mol/L的溶液为酸性或者碱性溶液,碱性溶液中镁离子与氢氧根离子反应;
C.在
=1×1012的溶液中氢氧根离子浓度为0.01mol/L,NH4+、Fe2+离子之间不能共存;
D.
=10-10 mol?L-1的溶液中氢离子浓度为10-3mol/l与碳酸氢根离子不能共存.
B.由水电离产生的c(OH-)=1×10-10mol/L的溶液为酸性或者碱性溶液,碱性溶液中镁离子与氢氧根离子反应;
C.在
| c(OH-) |
| c(H+) |
D.
| KW |
| c(H+) |
解答:
解:A、能使pH试纸变红的溶液是酸性溶液,CO32-不能存在,故A错误;
B.由水电离产生的c(OH-)=1×10-10mol/L的溶液为酸性或者碱性溶液,碱性溶液中镁离子与氢氧根离子反应,但在酸性溶液中离子之间不发生反应,所以可能大量共存,故B正确;
C.在
=1×1012的溶液中氢氧根离子浓度为0.01mol/L,NH4+、Fe2+离子之间不能共存,故C错误;
D.
=10-10 mol?L-1的溶液中氢离子浓度为10-3mol/l与碳酸氢根离子不能共存,故D错误;
故选B.
B.由水电离产生的c(OH-)=1×10-10mol/L的溶液为酸性或者碱性溶液,碱性溶液中镁离子与氢氧根离子反应,但在酸性溶液中离子之间不发生反应,所以可能大量共存,故B正确;
C.在
| c(OH-) |
| c(H+) |
D.
| KW |
| c(H+) |
故选B.
点评:本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
下列事实中能说明亚硝酸(HNO2)是弱电解质的是( )
| A、亚硝酸不与氯化钠反应 |
| B、用HNO2溶液做导电试验,灯光较暗 |
| C、HNO2不稳定 |
| D、常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L |
某溶液中存在大量的H+、NO3-、Cl-,该溶液中还可能大量存在的离子是( )
| A、CO32- |
| B、OH- |
| C、Ag+ |
| D、SO42- |
下列说法正确的是( )
| A、含有离子键和共价键的化合物一定是离子化合物 |
| B、11H2O.12H2O.13H2O互为同位素 |
| C、目前人们已发现的元素种类数目与原子种类数目相同 |
| D、多电子原子中,在离核较近的区域内运动的电子能量较高 |
下列说法正确的是( )
| A、S2-电子排布式 1s22s22p63s23p4 |
| B、在金属晶体中,自由电子与金属离子或金属原子的碰撞有能量传递,可以用此来解释的金属的物理性质是导热性 |
| C、金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性 |
D、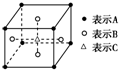 某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶胞中A、B、C的原子个数比为1:2:2. |
下列描述正确的是( )
| A、HCl和NaOH反应的中和热△H=-57.3kJ/mol,则NaOH和CH3COOH反应的中和热△H=-57.3kJ/mol |
| B、需要加热才能发生的反应一定是吸热反应 |
| C、CO(g)的燃烧热是-283.0kJ/mol,则2CO(g)+O2(g)=2CO2(g)反应的△H=-2×283.0kJ/mol |
| D、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |