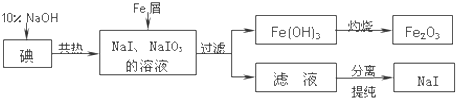
题目内容
下列说法正确的是( )
| A、含有离子键和共价键的化合物一定是离子化合物 |
| B、11H2O.12H2O.13H2O互为同位素 |
| C、目前人们已发现的元素种类数目与原子种类数目相同 |
| D、多电子原子中,在离核较近的区域内运动的电子能量较高 |
考点:离子化合物的结构特征与性质,核素,共价键的形成及共价键的主要类型
专题:
分析:A.离子化合物的概念为:含有离子键的化合物;
B.同位素:质子数相同,中子数不同的同种元素的不同核素;
C.有些元素存在同位素;
D.在多电子原子中,在离核较近的区域内运动的电子能量较低.
B.同位素:质子数相同,中子数不同的同种元素的不同核素;
C.有些元素存在同位素;
D.在多电子原子中,在离核较近的区域内运动的电子能量较低.
解答:
解:A.只要含有离子键的化合物一定是离子化合物,故A正确;
B.同位素研究对象为原子,11H2O.12H2O.13H2O都是物质,故B错误;
C.有些元素存在同位素例如氢元素存在:H、D、T三种原子,所以原子的种类多于元素,故C错误;
D.在多电子原子中,在离核较近的区域内运动的电子能量较低,在离核较远的区域内运动的电子能量较高,故D错误;
故选:A.
B.同位素研究对象为原子,11H2O.12H2O.13H2O都是物质,故B错误;
C.有些元素存在同位素例如氢元素存在:H、D、T三种原子,所以原子的种类多于元素,故C错误;
D.在多电子原子中,在离核较近的区域内运动的电子能量较低,在离核较远的区域内运动的电子能量较高,故D错误;
故选:A.
点评:本题考查了化学相关概念及核外电子排布规律,明确离子化合物、同位素概念是解题关键,注意同位素、同素异形体、同分异构体区别.

练习册系列答案
相关题目
有甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、CO32-、SO42-中的不同阴、阳离子各一种组成.已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③丙溶液中滴入AgNO3溶液,有不溶于稀HNO3的白色沉淀生成.下列结论不正确的是( )
| A、甲溶液含有Ba2+ |
| B、乙溶液含有SO42- |
| C、丙溶液含有Cl- |
| D、丁溶液含有Mg2+ |
在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g),已知H2、I2、HI、的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、HI为0.3mol/L |
| B、I2为0.4mol/L |
| C、H2为0.2mol/L |
| D、HI为0.4mol/L |
下列反应中,水作还原剂的是( )
| A、CO2+H2O=H2CO3 |
| B、Na2O+H2O=2NaOH |
| C、2Na+2H2O=2NaOH+H2↑ |
| D、2F2+2H2O=4HF+O2 |
室温下,下列各组离子在相应的条件下可能大量共存的是( )
| A、能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ | ||
| B、由水电离产生的c(OH-)=1×10-10 mol?L-1的溶液中:NO3-、Mg2+、Na+、SO42- | ||
C、在
| ||
D、
|
如图BF3与一定量的水形成(H2O)2?BF3晶体Q,Q在一定条件下可转化为R,反应过程中新形成的化学键包括( )


| A、离子键 | B、配位键 |
| C、金属键 | D、氢键 |
已知A2-离子共含有x个中子,A元素的质量数为m,则n克A2-离子共含有电子的物质的量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列有关化学用语表示正确的是( )
A、N2的电子式: | ||
B、S2-的结构示意图: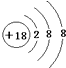 | ||
C、质子数为53、中子数为78的碘原子:
| ||
| D、16O2与18O3互为同位素 |