题目内容
(1)研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义.以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示) .
(2)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
则表示甲烷燃烧热的热化学方程式 .
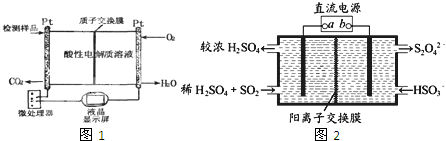
(3)如图1所示是用于合成甲醇产品中甲醇含量的检测仪.写出该仪器工作时的电极反应式:负极反应式:
(4)利用如图2所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2.下列说法正确的是
阴极的电极反应式为:
(5)工业常用Na2CO3饱和溶液回收NO、NO2气体:NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为 .
(2)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活.
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H=-1214kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
则表示甲烷燃烧热的热化学方程式
(3)如图1所示是用于合成甲醇产品中甲醇含量的检测仪.写出该仪器工作时的电极反应式:负极反应式:
(4)利用如图2所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2.下列说法正确的是
阴极的电极反应式为:

(5)工业常用Na2CO3饱和溶液回收NO、NO2气体:NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为
考点:原电池和电解池的工作原理,绿色化学,化学方程式的有关计算,用盖斯定律进行有关反应热的计算
专题:
分析:(1)根据“绿色化学”的特征:反应物中原子全部转化为欲制得的产物,即原子的利用率为100%;
(2)已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ?mol-1,②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ?mol-1,依据盖斯定律计算,①+②得到热化学方程式;
(3)甲醇为负极,被氧化生成二氧化碳和水;
(4)阴极发生还原反应,HSO3-被还原生成S2O42-;
(5)设NO的物质的量是x,NO2的物质的量是y,结合质量守恒列式计算.
(2)已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ?mol-1,②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ?mol-1,依据盖斯定律计算,①+②得到热化学方程式;
(3)甲醇为负极,被氧化生成二氧化碳和水;
(4)阴极发生还原反应,HSO3-被还原生成S2O42-;
(5)设NO的物质的量是x,NO2的物质的量是y,结合质量守恒列式计算.
解答:
解:(1)以CO与H2为原料,在一定条件下均可合成甲醇:CO(g)+2H2(g)
CH3OH(g);
以CO2与H2为原料,在一定条件下均可合成甲醇:CO2(g)+3H2(g)
CH3OH(g))+H2O,
以CO与H2为原料,产物只有一种吗,符合符合“绿色化学”的思想,
故答案为:CO(g)+2H2(g)
CH3OH(g);
(2)①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ?mol-1,
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ?mol-1,
依据盖斯定律计算,①+②得到,2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)△H=-1780KJ/mol;
热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ?mol-1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ?mol-1;
(3)负极上燃料失电子和水反应生成氢离子和二氧化碳.电极反应式为:负极:CH3OH+H2O-6e-═6H++CO2,
故答案为:CH3OH+H2O-6e-═6H++CO2;
(4)阴极发生还原反应,HSO3-被还原生成S2O42-,阴极的电极反应式为:2HSO3-+2H++2e-═S2O42-+2H2O,故答案为:2HSO3-+2H++2e-═S2O42-+2H2O;
(5)设NO的物质的量是x,NO2的物质的量是y,则
解得:x=
,y=
;即一氧化氮和二氧化氮的物质的量之比为:
:
=1:7,所以相同条件下,一氧化氮和二氧化氮的体积之比是1:7,
故答案为:1:7.
| 一定条件 |
以CO2与H2为原料,在一定条件下均可合成甲醇:CO2(g)+3H2(g)
| 一定条件 |
以CO与H2为原料,产物只有一种吗,符合符合“绿色化学”的思想,
故答案为:CO(g)+2H2(g)
| 一定条件 |
(2)①2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H1=-1214kJ?mol-1,
②2CO(g)+O2(g)=2CO2(g)△H2=-566kJ?mol-1,
依据盖斯定律计算,①+②得到,2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)△H=-1780KJ/mol;
热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ?mol-1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ?mol-1;
(3)负极上燃料失电子和水反应生成氢离子和二氧化碳.电极反应式为:负极:CH3OH+H2O-6e-═6H++CO2,
故答案为:CH3OH+H2O-6e-═6H++CO2;
(4)阴极发生还原反应,HSO3-被还原生成S2O42-,阴极的电极反应式为:2HSO3-+2H++2e-═S2O42-+2H2O,故答案为:2HSO3-+2H++2e-═S2O42-+2H2O;
(5)设NO的物质的量是x,NO2的物质的量是y,则
|
解得:x=
| 1 |
| 4 |
| 7 |
| 4 |
| 1 |
| 4 |
| 7 |
| 4 |
故答案为:1:7.
点评:本题考查较为综合,涉及绿色化学、燃料电池,为高频考点,侧重于学生的分析能力和实验能力的考查,综合性较强,难度中等.

练习册系列答案
相关题目
下列分子的VSEPR模型与分子立体结构模型一致的是( )
| A、NH3 |
| B、CCl4 |
| C、H2O |
| D、PCl3 |
在0.1mol?L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+.对于该平衡,下列叙述正确的是( )
| A、加入水时,CH3COOH的电离程度增大 |
| B、加入少量NaOH固体,平衡向正反应方向移动 |
| C、通入少量 HCl气体,溶液中c(H+)减小 |
| D、加入少量CH3COONa固体,平衡向正反应方向移动 |
下列各组中的离子,在同一溶液中不能同时大量共存的是( )
| A、K+、Al3+、SO42-、OH- |
| B、Na+、Cu2+、Cl-、SO42- |
| C、SO42-、H+、Cl-、Na+ |
| D、K+、Mg2+、CO32-、NO3- |
在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g),已知H2、I2、HI、的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、HI为0.3mol/L |
| B、I2为0.4mol/L |
| C、H2为0.2mol/L |
| D、HI为0.4mol/L |
若将某种富含维生素C的水果切碎捣烂,加水溶解,提取其滤液就能达到充分提取水果中的维生素c的目的,这说明服用维生素c可使食物中的Fe3+转化成Fe2+,有利于人体吸收,在该化学反应中维生素c体现( )
| A、能溶于水,氧化性 |
| B、不能溶于水,氧化性 |
| C、能溶于水,还原性 |
| D、不能溶于水,还原性 |
室温下,下列各组离子在相应的条件下可能大量共存的是( )
| A、能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+ | ||
| B、由水电离产生的c(OH-)=1×10-10 mol?L-1的溶液中:NO3-、Mg2+、Na+、SO42- | ||
C、在
| ||
D、
|
将标准状况下密度为ρg/L的HCl气体V L溶于1000g水中,得到密度为b g/cm3的盐酸,则该盐酸的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
 熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO-52e-═34CO2+10H2O.
熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO-52e-═34CO2+10H2O.