题目内容
20.下列说法正确的是( )| A. | 室温下用广范pH试纸测得某氯水的pH=4 | |
| B. | 酸式滴定管的润洗操作:关闭滴定管活塞,往上口加入3~5mL待装液,倾斜着转动滴定管,使液体润湿滴定管内壁,然后将液体从上口倒出,重复此操作2~3次 | |
| C. | 若酸碱中和滴定过程中用待测液润洗锥形瓶,则测定结果偏高 | |
| D. | 酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性 |
分析 A、根据氯水具有酸性和漂白性;
B、根据润洗后,从滴定管的下口放出;
C、根据用待测液润洗锥形瓶,溶质增加;
D、根据反应生成的盐类是否发生水解来解答.
解答 解:A、氯水具有酸性和漂白性,滴入到PH试纸,试纸先变红,后变白,不能测量氯水的pH值,故A错误;
B、润洗后,从滴定管的下口放出,不能从上口倒出,其他操作均合理,故B错误;
C、若酸碱中和滴定过程中用待测液润洗锥形瓶,会导致待测液中溶质的物质的量增大,使用的标准液体积偏大,将导致测定结果偏高,故C正确;
D、酸和碱恰好完全反应,若是强酸强碱反应,溶液呈中性,若是强酸弱碱反应,溶液呈酸性,若是弱酸强碱反应溶液呈碱性,故D错误;
故选C.
点评 本题考查了实验方案评价,涉及酸碱中和滴定、物质的性质等知识点,明确物质的性质、实验基本操作规范性即可解答.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
20.下列哪种物质可以鉴别乙醇和苯酚( )
| A. | NaCl溶液 | B. | NaHCO3溶液 | C. | H2SO4溶液 | D. | FeCl3溶液 |
1.下列有关说法正确的是( )
| A. | △H>0的反应一定不能自发进行 | |
| B. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | |
| C. | 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 | |
| D. | 在5NH4NO3=2HNO3+4N2↑+9H2O中,生成28gN2时转移的电子数目为3.75mol |
5.下列物质性质与应用对应关系正确的是( )
| A. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 | |
| B. | 浓硫酸具有脱水性,可用于干燥氯气 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铝熔点很高,可用于制耐火材料 |
12.蛇纹石矿可以看做由MgO、Fe2O3、Al2O3和SiO2组成,某实验小组设计如下流程欲分别制得单质Mg、Fe、Al和Si.
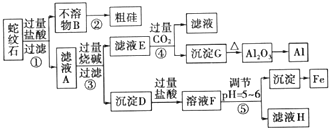
有关氢氧化物沉淀时的pH见表
请回答下列问题:
(1)滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+
(2)操作②中涉及的化学方程式为2C+SiO2 $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)除去MgCl2溶液中的HCl,可以选用的试剂为cd(填字母)
a.NaOH溶液 b.氨水c.MgO d.Mg(0H)2
(4)由滤液H制取金属Mg的流程如下:
滤液H$\stackrel{加热浓缩}{→}$ $\stackrel{冷却结晶}{→}$MgCl2•6H2O$\stackrel{脱水}{→}$MgCl2→Mg
该流程中由MgCl2冶炼Mg的方法是电解
(5)工业上常用碱液除去铝表面的氧化膜,碱洗时常有气泡冒出,原因是2Al+2OH-+2H2O═2AlO2-+3H2↑(用离子方程式表示),为将碱洗液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的b
a.NH3 b.CO2c.NaOH d.HNO3.

有关氢氧化物沉淀时的pH见表
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
(1)滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+
(2)操作②中涉及的化学方程式为2C+SiO2 $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)除去MgCl2溶液中的HCl,可以选用的试剂为cd(填字母)
a.NaOH溶液 b.氨水c.MgO d.Mg(0H)2
(4)由滤液H制取金属Mg的流程如下:
滤液H$\stackrel{加热浓缩}{→}$ $\stackrel{冷却结晶}{→}$MgCl2•6H2O$\stackrel{脱水}{→}$MgCl2→Mg
该流程中由MgCl2冶炼Mg的方法是电解
(5)工业上常用碱液除去铝表面的氧化膜,碱洗时常有气泡冒出,原因是2Al+2OH-+2H2O═2AlO2-+3H2↑(用离子方程式表示),为将碱洗液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的b
a.NH3 b.CO2c.NaOH d.HNO3.
9.下列是从化学角度对成语、谚语、俗语进行的分析,其中正确的是( )
| 选项 | 成语、谚语、俗语 | 理解或寓意 |
| A | “甘之如饴” | 糖类均有甜味 |
| B | “冰、水为之,而寒于水” | 相同质量和温度的水和冰,冰的能量高 |
| C | “雷雨肥庄稼” | 农作物生长需要水,雷雨天提供了大量的雨水 |
| D | “春蚕到死丝方尽” | 蚕丝的只要成分是蛋白质 |
| A. | A | B. | B | C. | C | D. | D |