题目内容
15.甲醛是深受关注的有机化合物.甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠.(1)将4.00mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,用浓度为1.100mol•L-1的硫酸滴定,至终点时耗用硫酸20.00mL.甲醛水溶液的浓度为11mol•L-1.上述滴定中,若滴定管规格为50mL,甲醛水溶液取样不能超过10mL.
(2)甲醛可和新制氢氧化铜的反应发生反应的化学方程式通常表示如下:HCHO+2Cu(OH)2$\stackrel{△}{→}$HCOOH+Cu2O↓+2H2O.在该反应中体现了甲醛的还原性(填“氧化性”、“还原性”)每1mol甲醛参加反应转移的电子数为1.204×1024个.甲醛中的碳的杂化方式为sp2.(填sp、sp2、sp3)
分析 在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等;
(1)将4.00mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,得到溶液中含有NaOH,由硫酸的物质的量可得NaOH,以此确定甲醛的物质的量,进而计算浓度;若滴定管规格为50mL,如硫酸全部反应,体积为50mL,则可知消耗硫酸的物质的量,可知需要甲醛的物质的量,结合其浓度,可确定体积;
(2)根据HCHO分子中碳原子化合价为0价,HCHO+2Cu(OH)2$\stackrel{△}{→}$HCOOH+Cu2O↓+2H2O,HCOOH中碳原子化合价为+2价,化合价升高,还原剂,具有还原性,1个HCHO转移2个电子;根据价层电子对互斥模型判断.
解答 解:(1)产生的氢氧化钠的物质的量与甲醛的物质的量相等,n(H2SO4)=1.100mol•L-1×0.02L=0.022mol,将4.00mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,得到溶液中含有NaOH,加入硫酸发生反应:H2SO4+2NaOH=Na2SO4+2H2O,则n(HCHO)=n(NaOH)=2n(H2SO4)=0.022mol×2=0.044mol,c(HCHO)=$\frac{0.044mol}{0.004L}$=11mol/L;
若滴定管规格为50mL,如硫酸全部反应,体积为50mL,则可知消耗硫酸的物质的量为0.05L×11mol/L=0.055mol,则n(HCHO)=n(NaOH)=2n(H2SO4)=0.11mol,甲醛水溶液取样不能超过的体积为V=$\frac{n}{c}$=$\frac{0.11mol}{11mol/L}$=0.01L=10mL;
故答案为:11;10;
(2)HCHO分子中碳原子化合价为0价,HCHO+2Cu(OH)2$\stackrel{△}{→}$HCOOH+Cu2O↓+2H2O,HCOOH中碳原子化合价为+2价,化合价升高,还原剂,具有还原性;每1mol甲醛参加反应转移的电子数为2NA,即1.204×1024,甲醛分子内碳原子形成3个σ键,无孤对电子,杂化方式为sp2杂化,立体构型为平面三角形;
故答案为:还原性;1.204×1024;sp2.
点评 本题以甲醛为载体综合考查物质的含量测定、杂化理论的应用,侧重于学生的分析,有利于培养学生良好的科学素养,提高学习的积极性,难度中等.

| A. | 100 mL | B. | 45 mL | C. | 10 mL | D. | 15 mL |
用4.0mL 0.001mol/L KMnO4溶液与2.0mL 0.010mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
| 实验组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2.0mL | 20 | / |
| Ⅱ | 2.0mL | 20 | 少量MnSO4粉末 |
| Ⅲ | 2.0mL | 30 | / |
| Ⅳ | 1.0mL | 20 | 1.0mL蒸馏水 |
(2)本实验可通过观察高锰酸钾溶液完全褪色的时间来比较各组反应的反应速率大小,要观察到预期现象,草酸的物质的量必须满足过量(填“过量”、“恰好完全反应”或“不够反应量”)的条件.
(3)对比实验I和II,可以研究催化剂对化学反应速率的影响.
(4)对比实验I和IV,可以研究H+的浓度(或硫酸溶液的浓度)对化学反应速率的影响,实验IV加人1.0mL蒸馏水的目的是确保溶液总体积相同,仅改变硫酸的浓度,而高锰酸钾浓度和草酸浓度都相同.
| A. | ③⑥①②⑤④ | B. | ⑤①②⑥④③ | C. | ⑤④③②①⑥ | D. | ③①②④⑤⑥ |
| A. | 室温下用广范pH试纸测得某氯水的pH=4 | |
| B. | 酸式滴定管的润洗操作:关闭滴定管活塞,往上口加入3~5mL待装液,倾斜着转动滴定管,使液体润湿滴定管内壁,然后将液体从上口倒出,重复此操作2~3次 | |
| C. | 若酸碱中和滴定过程中用待测液润洗锥形瓶,则测定结果偏高 | |
| D. | 酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性 |
| A. | 硅(半导体材料) | B. | 二氧化硅(制光导纤维) | ||
| C. | Na2Si03 (用作粘合剂,俗称水玻璃) | D. | Al(OH)3(用作胃药,俗称人造刚玉) |

实验 记录 | ①Zn质量减少,Cu质量不变; ②外电路电流方向是:由Cu→Zn; ③SO42- 向Cu极移动; ④Zn电极发生氧化反应; ⑤正极反应式:Cu2++2e-═Cu |
| A. | ①②④ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
| A. | 粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-═Cu2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
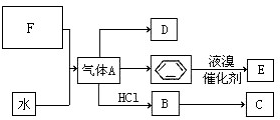 已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空: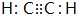 ;C的结构简式
;C的结构简式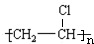 ;
;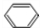 +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$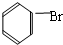 +HBr,其反应类型为取代反应;
+HBr,其反应类型为取代反应;