题目内容
1.下列有关说法正确的是( )| A. | △H>0的反应一定不能自发进行 | |
| B. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大 | |
| C. | 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同 | |
| D. | 在5NH4NO3=2HNO3+4N2↑+9H2O中,生成28gN2时转移的电子数目为3.75mol |
分析 A.反应自发进行的判断依据是△H-T△S<0;
B.醋酸为弱酸,pH均为2的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大与盐酸,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,根据n=C×V比较二者的体积关系;
C.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,前者为盐析,后者为蛋白质变性;
D.5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,转移15mol电子时生成4mol氮气.
解答 解:A.化学反应能否自发进行的判断依据是:△G=△H-T△S,当△G>0,反应一定不自发;当△G<0,反应一定自发,所以焓变和熵变都不能独立地作为反应自发性的判据,故A错误;
B.醋酸为弱酸,pH均为2的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大与盐酸,设盐酸的浓度为C1,醋酸的浓度为C2,则C1<C2,
分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,则有:n=C1V1=C2V2,因C1<C2,
所以:V1>V2,消耗盐酸的体积更大,故B错误;
C.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,饱和Na2SO4溶液降低蛋白质溶解度,为盐析现象,为可逆过程,再加入水可以溶解,硝酸具有强氧化性,使蛋白质变性,过程不可能,二者原理不同,故C正确;
D.5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,转移15mol电子时生成4mol氮气,故当生成28g氮气时物质的量为1mol氮气时,转移3.75mol电子即转移的电子数目3.75NA个,故D错误.
故选C.
点评 本题侧重对化学反应原理考查,涉及反应自发性判断、蛋白质的性质、反应速率影响因素、氧化还原反应电子转移数的计算等,注意C选项中蛋白质变性的一些方法,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 氯气和水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | Na2S水解的离子方程式:S2-+2H2O?H2S+2OH- |
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 石墨晶体中只有共价键,不存在其他的作用力 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
| A. | “水滴石穿”是溶解了CO2的雨水与CaCO3的长期作用,生成了可溶性的Ca(HCO3)2 | |
| B. | 新型水处理剂高铁酸钠(Na2FeO4),因为具有强氧化性,所以能对水进行消毒,同时,还原产物能形成带电的氢氧化铁胶体,能使水中的杂质沉降而达到净水的目的 | |
| C. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可以缓解白色污染 | |
| D. | 如果人觉察到室内煤气浓度较高的时候,应该将头尽量贴地,匍匐行进至门口或者窗口,不要急着打开电灯 |
用4.0mL 0.001mol/L KMnO4溶液与2.0mL 0.010mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
| 实验组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2.0mL | 20 | / |
| Ⅱ | 2.0mL | 20 | 少量MnSO4粉末 |
| Ⅲ | 2.0mL | 30 | / |
| Ⅳ | 1.0mL | 20 | 1.0mL蒸馏水 |
(2)本实验可通过观察高锰酸钾溶液完全褪色的时间来比较各组反应的反应速率大小,要观察到预期现象,草酸的物质的量必须满足过量(填“过量”、“恰好完全反应”或“不够反应量”)的条件.
(3)对比实验I和II,可以研究催化剂对化学反应速率的影响.
(4)对比实验I和IV,可以研究H+的浓度(或硫酸溶液的浓度)对化学反应速率的影响,实验IV加人1.0mL蒸馏水的目的是确保溶液总体积相同,仅改变硫酸的浓度,而高锰酸钾浓度和草酸浓度都相同.
| A. | 室温下用广范pH试纸测得某氯水的pH=4 | |
| B. | 酸式滴定管的润洗操作:关闭滴定管活塞,往上口加入3~5mL待装液,倾斜着转动滴定管,使液体润湿滴定管内壁,然后将液体从上口倒出,重复此操作2~3次 | |
| C. | 若酸碱中和滴定过程中用待测液润洗锥形瓶,则测定结果偏高 | |
| D. | 酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性 |
| A. | 2412Mg和2612Mg | B. | O2和O3 | C. | NO和NO2 | D. | H2O和H2O2 |
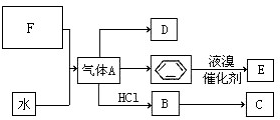 已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空: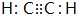 ;C的结构简式
;C的结构简式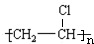 ;
;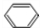 +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$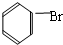 +HBr,其反应类型为取代反应;
+HBr,其反应类型为取代反应;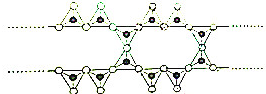 在结构中,
在结构中,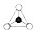 表示硅氧四面体(SiO4),则该结构式的通式为(Si6O17)n10n-.
表示硅氧四面体(SiO4),则该结构式的通式为(Si6O17)n10n-.