题目内容
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为
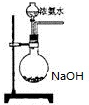
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如图,请结合化学用语从化学平衡的角度解释:
(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.肼--空气燃料电池是一种碱性电池,该电池放电时,负极的反应式
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物.首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙.已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式
考点:氨的制取和性质,氮的氧化物的性质及其对环境的影响,二氧化硫的化学性质
专题:元素及其化合物
分析:(1)氨气分子中氮原子和每个H原子之间都存在一对共用电子对;
(2)实验室用氯化铵和氢氧化钙加热制取氨气;氯化铵溶液显酸性是因为铵根离子的水解,在氯化铵溶液中由于铵根离子的水解,导致铵根离子浓度小于氯离子但远远大于氢离子和氢氧根离子的浓度;
(3)氨气溶于水生成一水合氨、一水合氨电离生成铵根离子和氢氧根离子,氨气、一水合氨和铵根离子之间都存在平衡关系,溶液中氢氧根离子浓度增大,抑制氨气溶解;
(4)二氧化硫和氯化钡不反应,氨气和二氧化硫、水反应生成亚硫酸铵,亚硫酸铵和氯化钡发生复分解反应;二氧化硫能被硝酸氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
(5)燃料电池中,负极上燃料失电子发生氧化反应;
(6)NO、二氧化氮和氧气、氢氧化钙反应生成硝酸钙和水.
(2)实验室用氯化铵和氢氧化钙加热制取氨气;氯化铵溶液显酸性是因为铵根离子的水解,在氯化铵溶液中由于铵根离子的水解,导致铵根离子浓度小于氯离子但远远大于氢离子和氢氧根离子的浓度;
(3)氨气溶于水生成一水合氨、一水合氨电离生成铵根离子和氢氧根离子,氨气、一水合氨和铵根离子之间都存在平衡关系,溶液中氢氧根离子浓度增大,抑制氨气溶解;
(4)二氧化硫和氯化钡不反应,氨气和二氧化硫、水反应生成亚硫酸铵,亚硫酸铵和氯化钡发生复分解反应;二氧化硫能被硝酸氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
(5)燃料电池中,负极上燃料失电子发生氧化反应;
(6)NO、二氧化氮和氧气、氢氧化钙反应生成硝酸钙和水.
解答:
解:(1)氨气分子中氮原子和每个H原子之间都存在一对共用电子对,且N原子还有一个孤电子对,所以氨气电子式为 ,
,
故答案为: ;
;
(2)实验室用氯化铵和氢氧化钙加热制取氨气,反应方程式为Ca(OH)2+2NH4Cl
CaCl2+2H2O+2NH3↑;产物为氯化铵,氯化铵溶液显酸性是因为铵根离子的水解,离子方程式为:NH4++H2O?NH3?H2O+H+;在氯化铵溶液中由于铵根离子的水解,导致铵根离子浓度小于氯离子但远远大于氢离子和氢氧根离子的浓度,离子浓度由大到小的顺序为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:Ca(OH)2+2NH4Cl
CaCl2+2H2O+2NH3↑;NH4++H2O?NH3?H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(3)NH3+H2O?NH3.H2O?NH4++OH-,NaOH溶于水发生电离,导致溶液中氢氧根离子浓度增大,平衡向生成氨气的方向移动,氨气逸出,
故答案为:NH3+H2O?NH3.H2O?NH4++OH-,NaOH溶于水发生电离,导致溶液中氢氧根离子浓度增大,平衡向生成氨气的方向移动,氨气逸出;
(4)二氧化硫和氯化钡不反应,氨气和二氧化硫、水反应生成亚硫酸铵,亚硫酸铵和氯化钡发生复分解反应,反应方程式为2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+;二氧化硫能被硝酸氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,反应方程式为3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+,
故答案为:2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+;3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+;
(5)燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为N2H4+4OH--4e-=N2+4H2O,故答案为:N2H4+4OH--4e-=N2+4H2O;
(6)NO、二氧化氮和氧气、氢氧化钙反应生成硝酸钙和水,反应方程式为3O2+2NO+6NO2+4Ca(OH)2=4Ca(NO3)2+4H2O,
故答案为:3O2+2NO+6NO2+4Ca(OH)2=4Ca(NO3)2+4H2O.
 ,
,故答案为:
 ;
;(2)实验室用氯化铵和氢氧化钙加热制取氨气,反应方程式为Ca(OH)2+2NH4Cl
| ||
故答案为:Ca(OH)2+2NH4Cl
| ||
(3)NH3+H2O?NH3.H2O?NH4++OH-,NaOH溶于水发生电离,导致溶液中氢氧根离子浓度增大,平衡向生成氨气的方向移动,氨气逸出,
故答案为:NH3+H2O?NH3.H2O?NH4++OH-,NaOH溶于水发生电离,导致溶液中氢氧根离子浓度增大,平衡向生成氨气的方向移动,氨气逸出;
(4)二氧化硫和氯化钡不反应,氨气和二氧化硫、水反应生成亚硫酸铵,亚硫酸铵和氯化钡发生复分解反应,反应方程式为2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+;二氧化硫能被硝酸氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,反应方程式为3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+,
故答案为:2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+;3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+;
(5)燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为N2H4+4OH--4e-=N2+4H2O,故答案为:N2H4+4OH--4e-=N2+4H2O;
(6)NO、二氧化氮和氧气、氢氧化钙反应生成硝酸钙和水,反应方程式为3O2+2NO+6NO2+4Ca(OH)2=4Ca(NO3)2+4H2O,
故答案为:3O2+2NO+6NO2+4Ca(OH)2=4Ca(NO3)2+4H2O.
点评:本题以氮的化合物为载体考查氧化还原反应、原电池原理等知识点,知道氨气的实验制法、化学平衡原理、原电池原理即可解答,难点是电极反应式书写,题目难度中等.

练习册系列答案
相关题目
下列电离方程式中,书写正确的是( )
| A、Na2SO4=2Na++SO4-2 |
| B、Ba(OH)2=Ba2++(OH-)2 |
| C、KClO3=K++Cl-+3O2- |
| D、Fe2(SO4)3=2Fe3++3SO42- |
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )
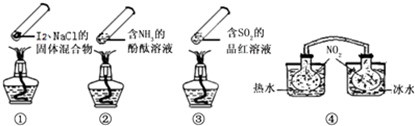

| A、加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 |
| B、加热时,②、③中的溶液均变红,冷却后又都变为无色 |
| C、④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D、四个“封管实验”中都有可逆反应发生 |
下列有关说法不正确的是( )
| A、常温下,PbSO4易溶于pH=7的CH3COONH4溶液,说明(CH3COO)2Pb是弱电解质 |
| B、向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)<Ksp(BaSO4) |
| C、潜艇上的核反应堆使用液态铝-钠合金作载热介质,若合金中n(Na)>n(Al),将其投入到足量的水中可得无色透明溶液 |
| D、向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-═I2+I- |
 A、B、D、E、F、G是原子序数依次增大的六种短周期元素.A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化物对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15.
A、B、D、E、F、G是原子序数依次增大的六种短周期元素.A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化物对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15.