题目内容
下表中对应关系正确的是( )
| A | 2Na+2H2O=2NaOH+H2↑ 3NO2+H20=NO+2HNO3 | 均为水作氧化剂的氧化还原反应 |
| B | SiO2能与NaOH溶液反应也能与氢氟酸反应 Al2O3能与NaOH溶液反应,也能与盐酸反应 | 两种氧化物均为两性氧化物 |
| C | Cl2+2Br-=2Cl-+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
| D | Cl2+2FeCl2=2FeCl3 I2+SO2+2H2O=H2SO4+2HI | 均属离子反应 |
| A、A | B、B | C、C | D、D |
考点:化学基本反应类型
专题:物质的性质和变化专题
分析:A、3NO2+H20=NO+2HNO3,NO2既是氧化剂又是还原剂;
B、SiO2是酸性氧化物;
C、Cl2+2Br-=2Cl-+Br2中单质被还原,Zn+Cu2+=Zn2++Cu中单质被氧化;
D、Cl2+2FeCl2=2FeCl3,I2+SO2+2H2O=H2SO4+2HI均属于离子反应.
B、SiO2是酸性氧化物;
C、Cl2+2Br-=2Cl-+Br2中单质被还原,Zn+Cu2+=Zn2++Cu中单质被氧化;
D、Cl2+2FeCl2=2FeCl3,I2+SO2+2H2O=H2SO4+2HI均属于离子反应.
解答:
解:A、3NO2+H20=NO+2HNO3,NO2既是氧化剂又是还原剂,水既不作氧化剂,也不作还原剂,故A错误;
B、SiO2是酸性氧化物,不是碱性氧化物,故B错误;
C、Cl2+2Br-=2Cl-+Br2中单质被还原,Zn+Cu2+=Zn2++Cu中单质被氧化,故C错误;
D、Cl2+2FeCl2=2FeCl3,I2+SO2+2H2O=H2SO4+2HI均属于离子反应,故D正确,
故选D.
B、SiO2是酸性氧化物,不是碱性氧化物,故B错误;
C、Cl2+2Br-=2Cl-+Br2中单质被还原,Zn+Cu2+=Zn2++Cu中单质被氧化,故C错误;
D、Cl2+2FeCl2=2FeCl3,I2+SO2+2H2O=H2SO4+2HI均属于离子反应,故D正确,
故选D.
点评:本题主要考查的是氧化还原反应的有关概念,属于基础题,需要掌握.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
下列离子或分子在溶液中能大量共存,但通入NO2后会发生化学反应且生成沉淀的一组是( )
| A、Ba2+、Na+、Cl-、HSO3- |
| B、NH4+、K+、ClO-、S2- |
| C、Cu2+、Fe2+、NO3-、SO42- |
| D、Ag+、Na+、NH3?H2O、SO42- |
在如图所示的装置中,烧瓶中盛有空气,广口瓶中盛放下列物质时可发生喷泉的选项是( )
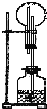

| A、块状大理石和稀硫酸 |
| B、NH4Cl与稀NaOH溶液 |
| C、Na2O2与NaOH溶液 |
| D、铜片与稀盐酸 |
常温熔融盐又称常温离子液体(ionic liquid),1914年报道的第一种离子液体硝酸乙基铵〔(C2H5NH3)NO3〕,其熔点为12℃.已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是( )
| A、该离子液体中含氨分子 |
| B、硝酸乙基铵水溶液呈碱性 |
| C、硝酸乙基铵水解的离子方程式可表示为:C2H5NH3++2H2O?C2H5NH2?H2O+H3O+ |
| D、同温度下相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH小 |
科学的实验方法为我们探索物质世界提供了一把金钥匙.下列实验方法正确的是( )
| A、实验室可通过蒸馏的方法,从含Fe3+的自来水中获得少量纯净水 |
| B、向样品中加入盐酸酸化的氯化钡溶液,以确定样品中是否含有SO42- |
| C、用洁净的玻璃棒蘸取待测液样品溶液置于酒精灯火焰上灼烧,检测是否含有Na+ |
| D、用干燥且洁净的玻璃棒蘸取待测溶液滴在湿润的pH试纸中部,跟标准比色卡对照可测定溶液的pH值 |
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.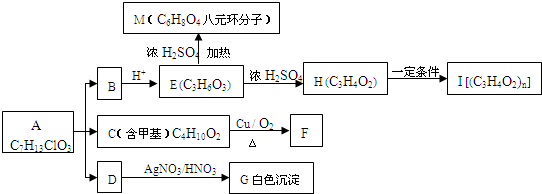
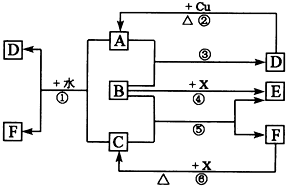 下列各物质为中学化学中常见物质,其中A、C、E、F为气体,B、D为无色液体,D是一种重要的化工原料,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,A是形成酸雨的主要气体.反应中部分生成物已略去.
下列各物质为中学化学中常见物质,其中A、C、E、F为气体,B、D为无色液体,D是一种重要的化工原料,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,A是形成酸雨的主要气体.反应中部分生成物已略去.