题目内容
下列有关说法不正确的是( )
| A、常温下,PbSO4易溶于pH=7的CH3COONH4溶液,说明(CH3COO)2Pb是弱电解质 |
| B、向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)<Ksp(BaSO4) |
| C、潜艇上的核反应堆使用液态铝-钠合金作载热介质,若合金中n(Na)>n(Al),将其投入到足量的水中可得无色透明溶液 |
| D、向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-═I2+I- |
考点:难溶电解质的溶解平衡及沉淀转化的本质,电解质与非电解质,弱电解质在水溶液中的电离平衡,钠的化学性质
专题:
分析:A、醋酸铅为易溶物,再根据离子反应发生发生的条件,醋酸铅不是气体,只能是弱电解质,该反应才能够发生;
B、洗净的沉淀中加稀盐酸,有气泡产生,不一定能说明Ksp(BaCO3)<Ksp(BaSO4),注意浓度的大小问题;
C、钠与水反应生成氢氧化钠,铝只能与氢氧化钠反应,依据2Al+2NaOH+2H2O=2NaAlO2+3H2↑判断;
D、前者溶液变蓝,后者有黄色沉淀,则KI3的溶液中含I2、I-.
B、洗净的沉淀中加稀盐酸,有气泡产生,不一定能说明Ksp(BaCO3)<Ksp(BaSO4),注意浓度的大小问题;
C、钠与水反应生成氢氧化钠,铝只能与氢氧化钠反应,依据2Al+2NaOH+2H2O=2NaAlO2+3H2↑判断;
D、前者溶液变蓝,后者有黄色沉淀,则KI3的溶液中含I2、I-.
解答:
解:A、硫酸铅与醋酸铵溶液反应得到无色澄清溶液,说明了醋酸铅为易溶物;由于硫酸铅为难溶物,根据离子反应发生条件可知,醋酸铅既然不是气体,所以一定为弱电解质,故A正确;
B、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,部分BaSO4因饱和Na2CO3溶液中高浓CO32-转化BaCO3,因此向洗净的沉淀中加稀盐酸,有气泡产生,但是Ksp(BaCO3)>Ksp(BaSO4),故B错误;
C、钠与水反应生成氢氧化钠,铝只能与氢氧化钠反应,依据2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,当n(Na)>n(Al),n(NaOH)>n(Al),可得无色透明溶液,故C正确;
D、向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,则KI3的溶液中含I2、I-,即KI3溶液中存在平衡为I3-?I2+I-,故D正确;
故选B.
B、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,部分BaSO4因饱和Na2CO3溶液中高浓CO32-转化BaCO3,因此向洗净的沉淀中加稀盐酸,有气泡产生,但是Ksp(BaCO3)>Ksp(BaSO4),故B错误;
C、钠与水反应生成氢氧化钠,铝只能与氢氧化钠反应,依据2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,当n(Na)>n(Al),n(NaOH)>n(Al),可得无色透明溶液,故C正确;
D、向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,则KI3的溶液中含I2、I-,即KI3溶液中存在平衡为I3-?I2+I-,故D正确;
故选B.
点评:本题考查了离子反应发生的条件、沉淀转化、氢氧化铝的两性,题目难度中等.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
科学的实验方法为我们探索物质世界提供了一把金钥匙.下列实验方法正确的是( )
| A、实验室可通过蒸馏的方法,从含Fe3+的自来水中获得少量纯净水 |
| B、向样品中加入盐酸酸化的氯化钡溶液,以确定样品中是否含有SO42- |
| C、用洁净的玻璃棒蘸取待测液样品溶液置于酒精灯火焰上灼烧,检测是否含有Na+ |
| D、用干燥且洁净的玻璃棒蘸取待测溶液滴在湿润的pH试纸中部,跟标准比色卡对照可测定溶液的pH值 |
下列物质可以通过化合反应制得的是( )
①FeCl3②FeCl2③CuS ④FeS ⑤Fe(OH)3.
①FeCl3②FeCl2③CuS ④FeS ⑤Fe(OH)3.
| A、①②④⑤ | B、①②③④⑤ |
| C、①④ | D、①④⑤ |
有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaClO 下列各项排序正确的是( )
| A、pH:②>③>④>① |
| B、c(CH3COO-):②>④>③>① |
| C、溶液中c(H+):①>③>②>④ |
| D、c(CH3COOH):①>④>③>② |
下列叙述正确的是( )
A、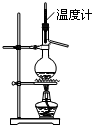 实验室用图所示装置制取乙烯 |
| B、由水电离出的c(H+)=10-13mol?L-1的溶液中,Na+、ClO-、K+、I-一定能大量共存 |
| C、肥皂的主要成分是高级脂肪酸盐 |
| D、某温度下Fe(OH)3的KSP=4×10-38,则该温度下,饱和溶液的c(OH-)=2×10-19 mol?L-1 |
通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量.下列各图所示的措施中,是为了加快化学反应速率的是( )
A、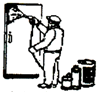 铁门表面喷漆 |
B、 橡胶里加炭黑 |
C、 扇子扇煤炉火 |
D、 木头电线杆 |
生活离不开化学,下列做法不合适的是( )
| A、用白醋清洗热水瓶中的水垢 |
| B、用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |
| C、用铝锅长时间存放剩菜 |
| D、利用激光笔区别鸡蛋白溶液和浓盐水 |
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.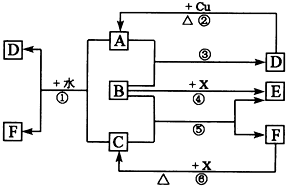 下列各物质为中学化学中常见物质,其中A、C、E、F为气体,B、D为无色液体,D是一种重要的化工原料,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,A是形成酸雨的主要气体.反应中部分生成物已略去.
下列各物质为中学化学中常见物质,其中A、C、E、F为气体,B、D为无色液体,D是一种重要的化工原料,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,A是形成酸雨的主要气体.反应中部分生成物已略去.