题目内容
1.从NO3-、SO42-、H+、Cu2+、Ag+、Cl-中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解,写出符合下列要求的所有可能的电解质的化学式.(1)两极分别放出H2和O2HNO3、H2SO4.
(2)若阴极析出金属,阳极放出O2CuSO4、AgNO3、Cu(NO3)2.
(3)两极分别放出气体,且体积比为1:1HCl.
分析 阴极上阳离子放电顺序为Ag+>Cu2+>H+,阳极上阴离子放电顺序为Cl->OH->SO42-、NO3-,
(1)当阴极放出H2,阳极放出O2时,则溶液中的电解质不放电,根据离子的放电顺序分析;
(2)当阴极析出金属,则金属离子为Cu2+或Ag+,阳极放出O2时,阴离子为SO42-或NO3-;
(3)当阴极放出H2,则阴极为H+放电,阳极放出Cl2阴离子为Cl-放电,此时两极分别放出气体,且体积比为1:1.
解答 解:阴极上阳离子放电顺序为Ag+>Cu2+>H+,阳极上阴离子放电顺序为Cl->OH->SO42-、NO3-,
(1)当阴极放出H2,阳极放出O2时,则溶液中的电解质不放电,溶液中阳离子为H+,阴离子为SO42-或NO3-,所以电解质是HNO3、H2SO4中的任意一种,故答案为:HNO3、H2SO4;
(2)当阴极析出金属,则金属离子为Cu2+或Ag+,阳极放出O2时,阴离子为SO42-或NO3-;所以电解质是CuSO4或AgNO3或Cu(NO3)2中的任意一种,
故答案为:CuSO4、AgNO3、Cu(NO3)2;
(3)当阴极放出H2,则阴极为H+放电溶液中的阳离子为H+,阳极放出Cl2阴离子为Cl-放电,所以电解质为HCl,
故答案为:HCl.
点评 本题考查电解原理,明确离子的放电顺序是解答本题的关键,注意电极材料与发生的电极反应即可解答,题目难度不大.

练习册系列答案
相关题目
12.25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ•mol-1,石墨的燃烧热为393.5kJ•mol-1.下列热化学方程式书写正确的是( )
| A. | H2SO4(aq)+Ba (OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | C (s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1 | |
| D. | C (s,石墨)+$\frac{1}{2}$O2(g)═CO (g)△H=-393.5kJ•mol-1 |
9.下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是( )
| A. | NaClO(aq)中通入过量SO2:ClO-+SO2+H2O=HClO+HSO3- | |
| B. | FeCl2在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH- | |
| C. | AlCl3(aq)中投入少量Na:Al3++4Na+2H2O=AlO2-+4Na++2H2↑ | |
| D. | FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
16.下列化合物在核磁共振氢谱中能出现两组峰.且其峰面积之比为3:1的为( )
| A. | 乙酸异丙酯 | B. | 甲酸甲酯 | C. | 对二甲苯 | D. | 硝基苯 |
6.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.01×105Pa,20℃时48g O3含有的分子数为NA | |
| B. | 1molNa2O2晶体中阴离子数为2 NA | |
| C. | 标准状况下,33.6L的 乙醇(C2H5OH)中含有的碳原子数目为3NA | |
| D. | 常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA |
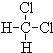 和
和 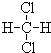
 与
与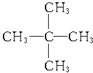
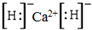 .
. ;D与E能形成一种非极性分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.
;D与E能形成一种非极性分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是H2S.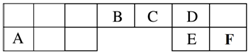 短周期元素(前18号元素)A、B、C、D、E、F在元素周期表中的位置如图所示,其中D为地壳中含量最高的元素.
短周期元素(前18号元素)A、B、C、D、E、F在元素周期表中的位置如图所示,其中D为地壳中含量最高的元素. .
.