题目内容
10.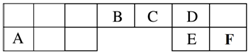 短周期元素(前18号元素)A、B、C、D、E、F在元素周期表中的位置如图所示,其中D为地壳中含量最高的元素.
短周期元素(前18号元素)A、B、C、D、E、F在元素周期表中的位置如图所示,其中D为地壳中含量最高的元素.请用化学用语回答下列问题:
(1)D元素离子结构示意图:
 .
.(2)F、E原子半径由大到小顺序为S>Cl.(用具体的微粒符号表示,下同)
(3)A和F均对应的最高价氧化物对应的水化物相互反应的化学方程式NaOH+HClO4=NaClO4+H2O.
(4)工业上制F单质的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
分析 短周期元素(前18号元素)A、B、C、D、E、F在元素周期表中的位置如图所示,D为地壳中含量最高的元素,则D为O元素;由元素在周期表中的相对位置可知,A为Na、B为碳元素、C为N元素、E为S元素、F为Cl,据此结合元素周期律知识进行解答.
解答 解:D为地壳中含量最高的元素,则D为O元素,由元素在周期表中相对位置可知,A为Na、B为碳元素、C为N元素、E为S元素、F为Cl,
(1)D为O元素,氧离子的核电荷数为8,核外电子总数为10,最外层满足8电子稳定结构,其离子结构示意图为: ,
,
故答案为: ;
;
(2)E为S元素、F为Cl,二者位于同一周期,原子序数越大,原子半径越小,则原子半径大小为:S>Cl,
故答案为:S>Cl;
(3)A、F的最高价氧化物对应的水化物分别为NaOH、HClO4,二者发生中和反应反应生成盐与水,反应的化学方程式为:NaOH+HClO4=NaClO4+H2O,
故答案为:NaOH+HClO4=NaClO4+H2O;
(4)F的单质为氯气,工业上通常电解饱和氯化钠溶液制备氯气,离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
点评 本题考查元素周期表与元素周期律应用,题目难度中等,明确原子结构与元素周期表的关系为解答关键,注意掌握元素周期律内容及应用方法,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.在同温同压下,下列各组热化学方程式中△H1>△H2的是( )
| A. | 2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | |
| B. | S(g)+O2(g)═2SO2(g);△H1 S(s)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
18.离子反应为aMnO4-+bI-+x H+→y Mn2++cI2+dIO3-+zH2O;根据该离子方程式,下列说法正确的是( )
| A. | 氧化性MnO4->IO3- | |
| B. | c=d=5,则该反应转移电子数为30e | |
| C. | 该反应的氧化产物只有IO3- | |
| D. | a、b、c、d之间的关系是:5a=2c+6d;b=2c+d |
5.分液漏斗可用来分离的物质是( )
| A. | 溶液中的溶质和溶剂 | B. | 悬浊液 | ||
| C. | 不能互溶的两种液体 | D. | 互溶的液体 |
2.有关化学用语正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | .硝基苯的结构简式: | ||
| C. | 四氯化碳的电子式: | D. | 甲烷分子的比例模型 |
20.在强酸性溶液中能大量共存,且溶液为无色透明的离子组是( )
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、CO32-、NO3- | ||
| C. | K+、NH4+、MnO4-、SO42- | D. | Na+、K+、NO3-、HCO3- |