题目内容
16.下列化合物在核磁共振氢谱中能出现两组峰.且其峰面积之比为3:1的为( )| A. | 乙酸异丙酯 | B. | 甲酸甲酯 | C. | 对二甲苯 | D. | 硝基苯 |
分析 核磁共振氢谱中能出现两组峰.说明含有2种H原子,其峰面积之比为3:1,说明H原子个数为3:1,结合对应物质的结构解答该题.
解答 解:A.乙酸异丙酯的结构简式为:CH3COOCH(CH3)2,该分子的核磁共振氢谱中有三组峰,其峰面积之比是6:3:1,故A错误;
B.甲酸甲酯的结构简式为:HCOOCH3,含有2种H原子,其峰面积之比为3:1,故B正确;
C.对二甲苯的结构简式为: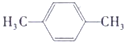 ,该分子的核磁共振氢谱中有两组峰,其峰面积之比是3:2,故C错误;
,该分子的核磁共振氢谱中有两组峰,其峰面积之比是3:2,故C错误;
D.硝基苯含有1个硝基,该分子的核磁共振氢谱中有三组峰,其峰面积之比是2:2:1,故D错误.
故选B.
点评 本题考查有机物的结构,为高频考点,侧重于学生的分析能力的考查,明确核磁共振氢谱中吸收峰的组数、面积之比的含义是解本题关键,注意能根据名称写出结构简式,难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
7.下列实验方法能够实现的是( )
| A. | 用10ml量筒量取7.5ml稀盐酸 | |
| B. | 用托盘天平称取25.20gNaCl晶体 | |
| C. | 用蒸发结晶的方法由硫酸铜溶液制取蓝帆 | |
| D. | 用100ml容量瓶配置0.5mol/l的Na2CO3溶液 |
8.利用100ml 0.5mol•L-1Na2CO3溶液配制Na+浓度为0.20mol•L-1的溶液,下列操作正确的是( )
| A. | 将该Na2CO3 溶液转移至250ml容量瓶中,加蒸馏水稀释至刻度线,摇匀 | |
| B. | 将该Na2CO3 溶液转移至250ml烧杯中,用量筒量取150ml蒸馏水加入,搅拌 | |
| C. | 将该Na2CO3 溶液转移至250ml烧杯中,用量筒量取400ml蒸馏水加入,搅拌 | |
| D. | 将该Na2CO3 溶液转移至500ml容量瓶中,加蒸馏水稀释至刻度线,摇匀 |
5.分液漏斗可用来分离的物质是( )
| A. | 溶液中的溶质和溶剂 | B. | 悬浊液 | ||
| C. | 不能互溶的两种液体 | D. | 互溶的液体 |
6.下列表示对应化学反应的离子方程式正确的是( )
| A. | 醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 碘水中通入足量的SO2:I2+SO2+2H2O=2I-+SO42-+4H+ | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 惰性电极电解MgCl2溶液:Cl-+2H2O=2OH-+H2↑+Cl2↑ |
 周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增.R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子.工业上通过分离液态空气获得X单质.Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和.Z基态原子的最外能层只有一个电子,其他能层均已充满电子.