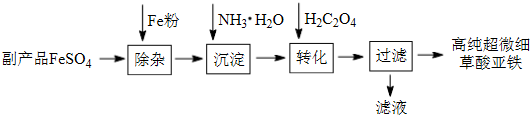
题目内容
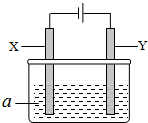 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)Y的电极名称是
(2)若X、Y都是惰性电极,a是硫酸钠溶液,实验开始时,同时在两边各滴入几滴石蕊试剂,一段时间后,在X极附近观察到的现是
(3)若X、Y都是惰性电极,a是足量的CuSO4溶液,写出电解过程的化学方程式
(4)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是
| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | Fe(NO3)3 |
| D | 铁 | 银 | AgNO3 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)和电源的正极相连的电极是电解池的阳极;
(2)电解硫酸钠,在阴极上是氢离子得电子的过程,在阳极上氢氧根离子失电子的过程;
(3)根据电解原理书写电解硫酸铜的电池反应,根据电子守恒进行计算即可;
(4)在电镀池中,镀层金属为阳极,镀件是阴极,电镀液是含有镀层金属阳离子的盐,据此回答.
(2)电解硫酸钠,在阴极上是氢离子得电子的过程,在阳极上氢氧根离子失电子的过程;
(3)根据电解原理书写电解硫酸铜的电池反应,根据电子守恒进行计算即可;
(4)在电镀池中,镀层金属为阳极,镀件是阴极,电镀液是含有镀层金属阳离子的盐,据此回答.
解答:
解:(1)Y和电源的正极相连,电极名称是阳极,故答案为:阳极;
(2)电解硫酸钠,在阴极上是氢离子得电子生成氢气的过程,氢离子浓度减小,溶液显碱性,遇到酚酞溶液变红,在阳极上氢氧根离子失电子的过程,即4OH --4e-=2H2O+O2↑,故答案为:产生气泡,溶液变红;4OH --4e-=2H2O+O2↑;
(3)电解硫酸铜,在阴极上是铜离子得电子的过程,在阳极上是氢氧根离子失电子的过程,总反应为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,电极上通过的电量为0.4mol时,根据电极反应:Cu2++2e-=Cu,生成金属铜是0.2mol,即12.8g,故答案为:12.8g;
(4)在铁表面镀一层金属银的电镀池中,镀层金属Ag为阳极,镀件Fe是阴极,电镀液是含有镀层金属阳离子的盐极硝酸银溶液,故答案为:D.
(2)电解硫酸钠,在阴极上是氢离子得电子生成氢气的过程,氢离子浓度减小,溶液显碱性,遇到酚酞溶液变红,在阳极上氢氧根离子失电子的过程,即4OH --4e-=2H2O+O2↑,故答案为:产生气泡,溶液变红;4OH --4e-=2H2O+O2↑;
(3)电解硫酸铜,在阴极上是铜离子得电子的过程,在阳极上是氢氧根离子失电子的过程,总反应为:2CuSO4+2H2O
| ||
(4)在铁表面镀一层金属银的电镀池中,镀层金属Ag为阳极,镀件Fe是阴极,电镀液是含有镀层金属阳离子的盐极硝酸银溶液,故答案为:D.
点评:本题考查学生原电池和电解池的工作原理知识,注意电极反应式的书写、根据电子守恒的计算是重点,难度中等.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
 如图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液的装置.用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀.下列说法正确的是( )
如图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液的装置.用该装置进行实验,反应开始后,观察到x电极附近出现白色沉淀.下列说法正确的是( )| A、A处通入的气体为O2,B处通入的气体为CH4 |
| B、电池内部K+向b极移动,OH-向a极移动 |
| C、图1装置中发生的总反应为CH4+2O2═CO2+2H2O |
| D、图1、图2中电解质溶液的pH均增大 |
PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放.通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx+CO
N2+CO2,下列关于此反应的说法中,不正确的是( )
| 催化剂 |
| A、所涉及元素中原子半径:C>N>O |
| B、等物质的量N2和CO2中,共价键的个数比为3:4 |
| C、氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
| D、当x=2时,每生成1mol N2,转移电子数为4mol |
 在一定温度下有pH均为2的X、Y、Z三种不同的一元酸各5mL,分别加水稀释到5000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
在一定温度下有pH均为2的X、Y、Z三种不同的一元酸各5mL,分别加水稀释到5000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A、若X、Y、Z都是弱酸,则a的值一定小于5 |
| B、三种酸的原来的浓度大小为X>Y>Z |
| C、稀释后X溶液中水的电离程度最小 |
| D、完全中和原X、Y两溶液时,消耗同浓度NaOH的体积 V(X)>V(Y) |
室温时,将浓度和体积分别为c1、V1的盐酸溶液和c2、V2的氨水溶液相混合,下列关于该混合溶液的叙述错误的是( )
| A、若pH<7时,则一定是c1V1=c2V2 |
| B、该混合液中,c(NH4+)+c(H+)═c(Cl-)+c(OH-) |
| C、当pH=7时,若V1=V2,则一定是c2> c1 |
| D、若V1=V2,c1=c2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
下列叙述不正确的是( )
| A、1H2和2H2互为同位素,性质相似 |
| B、元素的性质随着原子序数的递增呈周期性变化 |
| C、化学反应遵循质量守恒定律相能量守恒定律 |
| D、溶液、浊液、胶体的本质区别是分散质微粒大小不同 |
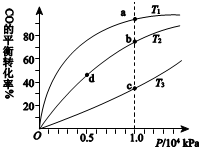 用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( )
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示.下列说法正确的是( )