题目内容
(1)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
(2)CuCl2溶液有时呈黄色,有时呈绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H2O)4]2++4Cl- 蓝色
[CuCl4]2-+4H2O黄色现欲使溶液由黄色变成蓝色,请写出一种可采用的方法: .
(3)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
试回答下列问题:
(1)若起始时c(CO)=2 mol?L-1,c(H2O)=3 mol?L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= 若降低温度,该反应的K值将 (填“增大”“减小”或“不变”).
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ?mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.2kJ?mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ?mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
(2)CuCl2溶液有时呈黄色,有时呈绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H2O)4]2++4Cl- 蓝色
[CuCl4]2-+4H2O黄色现欲使溶液由黄色变成蓝色,请写出一种可采用的方法:
(3)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
试回答下列问题:
(1)若起始时c(CO)=2 mol?L-1,c(H2O)=3 mol?L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=
考点:热化学方程式,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:(1)根据盖斯定律将三个化学方程式进行处理计算得到所需热化学方程式;
(2)使溶液由黄色变成蓝色,应使平衡向左移动,能够使化学平衡向逆反应方向移动的措施都是可以的;
(3)根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,代入平衡常数表达式计算平衡常数;
(2)使溶液由黄色变成蓝色,应使平衡向左移动,能够使化学平衡向逆反应方向移动的措施都是可以的;
(3)根据三段式解题法,求出反应混合物各组分浓度的变化量、平衡时各组分的浓度,代入平衡常数表达式计算平衡常数;
解答:
解:(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol;
(2)使溶液由黄色变成蓝色,应使平衡向左移动,能够使化学平衡向逆反应方向移动的措施即可,根据化学平衡移动原理,可以加入硝酸银溶液,使之和氯离子反应来减少氯离子的浓度,使得平衡左移,加入水稀释,平衡向着离子数目增加的方向进行,即向着逆反应方向进行;
故答案为:加入硝酸银溶液或加水稀释;
(3)平衡时CO的转化率为60%,则CO的浓度变化量=2mol/L×60%=1.2mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
故平衡常数K=
=1,温度降低,该反应是放热反应,化学平衡向着正向移动,二氧化碳和氢气浓度增大,一氧化碳和水的浓度减小,平衡常数K增大;
故答案为:1;增大;
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol ③
①×3-②-③×2得
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-24.8kJ/mol)×3-(-47.2kJ/mol)-(+640.5kJ/mol)×2=-1308.0kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol;
(2)使溶液由黄色变成蓝色,应使平衡向左移动,能够使化学平衡向逆反应方向移动的措施即可,根据化学平衡移动原理,可以加入硝酸银溶液,使之和氯离子反应来减少氯离子的浓度,使得平衡左移,加入水稀释,平衡向着离子数目增加的方向进行,即向着逆反应方向进行;
故答案为:加入硝酸银溶液或加水稀释;
(3)平衡时CO的转化率为60%,则CO的浓度变化量=2mol/L×60%=1.2mol/L,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始(mol/L):2 3 0 0
变化(mol/L):1.2 1.2 1.2 1.2
平衡(mol/L):0.8 1.8 1.2 1.2
故平衡常数K=
| 1.2×1.2 |
| 0.8×1.8 |
故答案为:1;增大;
点评:本题考查化学平衡常数、化学平衡的影响因素与平衡计算等,难度中等,掌握基础是关键.

练习册系列答案
相关题目
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰.在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH).下列说法正确的是( )
| A、该电池的正极为锌 |
| B、该电池反应中二氧化锰起催化剂作用 |
| C、电池负极反应式为:Zn+2OH--2e-═ZnO+H2O |
| D、当 0.l mol Zn 完全溶解时,流经电解液的电子个数为1.204×l023 |
在一个V升的密闭容器中放入2L A气体和1L B气体,在一定条件下发生反应:3A(g)+B(g)?nC(g)+2D(g),达到平衡后,A的浓度减小,混合气体的平均分子量增大,则该反应方程式中n值是( )
| A、1 | B、2 | C、3 | D、4 |
25℃、101kPa 下:①2Na(s)+
O2(g)→Na2O(s)+414KJ②2Na(s)+O2(g)→Na2O2(s)+511KJ
下列说法正确的是( )
| 1 |
| 2 |
下列说法正确的是( )
| A、①和②产物的阴阳离子个数比不相等 |
| B、①和②生成等物质的量的产物,转移电子数相同 |
| C、Na2O2(s)比Na2O(s)稳定 |
| D、1 mol Na2O2(s)与1 mol Na2O(s)所含的能量相差97kJ |
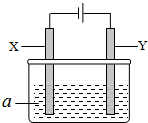 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: