题目内容
利用钛白工业的副产品FeSO4(含Al(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁,其工艺如下:
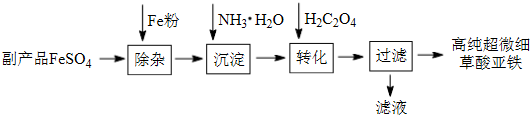
已知:①5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
②5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 ;
(2)滤液经处理可得到副产品 ;
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤一:准确称量一定量草酸亚铁样品,加入25mL 2mol/L的H2SO4溶解
步骤二:用0.2000mol/L标准KMnO4溶液滴定,消耗溶液10.00mL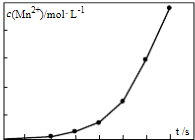
步骤三:向滴定后的溶液中加入2g Zn粉和5mL 2mol/L的H2SO4溶液,将Fe3+还原为Fe2+
步骤四:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00mL.
则样品中C2O42-的物质的量为 (写出计算过程);
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为 .

已知:①5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
②5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有
(2)滤液经处理可得到副产品
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤一:准确称量一定量草酸亚铁样品,加入25mL 2mol/L的H2SO4溶解
步骤二:用0.2000mol/L标准KMnO4溶液滴定,消耗溶液10.00mL

步骤三:向滴定后的溶液中加入2g Zn粉和5mL 2mol/L的H2SO4溶液,将Fe3+还原为Fe2+
步骤四:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00mL.
则样品中C2O42-的物质的量为
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为
考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:副产品FeSO4(含Al(SO4)3和少量重金属离子)中加入铁粉,将少量重金属离子等除去,得到比较纯净的FeSO4溶液,向FeSO4溶液中加入氨水,生成氢氧化亚铁,氢氧化亚铁和草酸反应生成高纯超微细草酸亚铁沉淀;
(1)温度不宜过高的原因除了控制沉淀的粒径外,还有NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解;
(2)沉淀前的溶液中含有硫酸亚铁,沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀和硫酸铵;
(3)多步反应找关系式;
(4)观察图象分析反应速率变大的因素.
(1)温度不宜过高的原因除了控制沉淀的粒径外,还有NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解;
(2)沉淀前的溶液中含有硫酸亚铁,沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀和硫酸铵;
(3)多步反应找关系式;
(4)观察图象分析反应速率变大的因素.
解答:
解:副产品FeSO4(含Al(SO4)3和少量重金属离子)中加入铁粉,将少量重金属离子等除去,得到比较纯净的FeSO4溶液,向FeSO4溶液中加入氨水,生成氢氧化亚铁,氢氧化亚铁和草酸反应生成高纯超微细草酸亚铁沉淀;
(1)沉淀过程为一水合氨沉淀亚铁离子的过程,生成氢氧化亚铁,氢氧化亚铁不稳定,受热会分解,另外一水合氨受热也会分解,故反应温度不能太高,所以温度不宜过高的原因除了控制沉淀的粒径外,还有NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解;
故答案为:NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热也易分解;
(2)沉淀前的溶液中含有硫酸亚铁,沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀和硫酸铵,所以副产品含有是(NH4)2SO4;
故答案为:(NH4)2SO4;
(3)由题意知氧化C2O42-和Fe2+共消耗0.2000 mol?L-1标准KMnO4溶液体积30.40 mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.00mL,所以C2O42-消耗KMnO4溶液体积为(30.40-10.00)=20.4mL,由5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O得5C2O42-~2MnO4-,所以n(C2O42-)=
n(MnO4-)=20.4ml×10-3×0.2000mol?L-1×
=0.0102mol;
故答案为:0.0102mol;
(4)从图象上观察,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中温度不变,随着反应的进行,反应物的浓度变小,而反应速率加快,只能是生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快;
故答案为:生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快.
(1)沉淀过程为一水合氨沉淀亚铁离子的过程,生成氢氧化亚铁,氢氧化亚铁不稳定,受热会分解,另外一水合氨受热也会分解,故反应温度不能太高,所以温度不宜过高的原因除了控制沉淀的粒径外,还有NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解;
故答案为:NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热也易分解;
(2)沉淀前的溶液中含有硫酸亚铁,沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀和硫酸铵,所以副产品含有是(NH4)2SO4;
故答案为:(NH4)2SO4;
(3)由题意知氧化C2O42-和Fe2+共消耗0.2000 mol?L-1标准KMnO4溶液体积30.40 mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.00mL,所以C2O42-消耗KMnO4溶液体积为(30.40-10.00)=20.4mL,由5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O得5C2O42-~2MnO4-,所以n(C2O42-)=
| 5 |
| 2 |
| 5 |
| 2 |
故答案为:0.0102mol;
(4)从图象上观察,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中温度不变,随着反应的进行,反应物的浓度变小,而反应速率加快,只能是生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快;
故答案为:生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快.
点评:主要考查物质的分离、提纯、制备以及反应速率等,综合性比较强,考查学生收集、整合、分析问题的能力,难度有点大.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
用水稀释0.1mol?L-1氨水时,溶液中随着水量的增加而减小的是 ( )
| A、c(OH-)/c(NH3?H2O) |
| B、c(NH3?H2O)/c(OH-) |
| C、c(H+)和c(OH-)的乘积 |
| D、c(H+) |
下列实验装置图正确的是( )
A、 分力乙醇和乙醛 |
B、 实验室制氨气 |
C、 反应热的测定 |
D、 实验室制乙酸乙酯 |
在一个V升的密闭容器中放入2L A气体和1L B气体,在一定条件下发生反应:3A(g)+B(g)?nC(g)+2D(g),达到平衡后,A的浓度减小,混合气体的平均分子量增大,则该反应方程式中n值是( )
| A、1 | B、2 | C、3 | D、4 |
已知:H2(g)+
O2(g)=H2O(g)△H=-242kJ/mol,断开1 mol O=O键和1 molH-O键所吸收的能量分别为496 kJ和463kJ,则断开1 mol H-H键所吸收的能量为( )
| 1 |
| 2 |
| A、920 kJ |
| B、557 kJ |
| C、436 kJ |
| D、188 kJ |
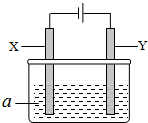 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: