题目内容
PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放.通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx+CO
N2+CO2,下列关于此反应的说法中,不正确的是( )
| 催化剂 |
| A、所涉及元素中原子半径:C>N>O |
| B、等物质的量N2和CO2中,共价键的个数比为3:4 |
| C、氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
| D、当x=2时,每生成1mol N2,转移电子数为4mol |
考点:氮的氧化物的性质及其对环境的影响,氧化还原反应,常见的生活环境的污染及治理
专题:氧化还原反应专题,元素及其化合物
分析:A、同周期自左而右原子半径减小;
B、x=2时,N元素由NO2中+4价降低为N2中0价,转移电子物质的量为N原子的4倍;
C、N2分子中含有N≡N三键,1molN2含有3mol共价键,CO2分子中含有2个C=O双键,1molCO2含有4mol共价键;
D、根据电子转移守恒计算NOx中N元素的化合价.
B、x=2时,N元素由NO2中+4价降低为N2中0价,转移电子物质的量为N原子的4倍;
C、N2分子中含有N≡N三键,1molN2含有3mol共价键,CO2分子中含有2个C=O双键,1molCO2含有4mol共价键;
D、根据电子转移守恒计算NOx中N元素的化合价.
解答:
解:A、同周期自左而右原子半径减小,故原子半径C>N>O,故A正确;
B、N2分子中含有N≡N三键,1molN2含有3mol共价键,CO2分子中含有2个C=O双键,1molCO2含有4mol共价键,故等物质的量N2和CO2中,共价键的个数比为3:4,故B正确;
C、令NOx中N元素的化合价为a,则1×(a-0)=1×(4-2),解得a=2,故C正确;
D、x=2时,N元素由NO2中+4价降低为N2中0价,转移电子物质的量为N原子的4倍,每生成1mol N2,转移电子数为1mol×2×4=8mol,故D错误;
故选D.
B、N2分子中含有N≡N三键,1molN2含有3mol共价键,CO2分子中含有2个C=O双键,1molCO2含有4mol共价键,故等物质的量N2和CO2中,共价键的个数比为3:4,故B正确;
C、令NOx中N元素的化合价为a,则1×(a-0)=1×(4-2),解得a=2,故C正确;
D、x=2时,N元素由NO2中+4价降低为N2中0价,转移电子物质的量为N原子的4倍,每生成1mol N2,转移电子数为1mol×2×4=8mol,故D错误;
故选D.
点评:本题考查原子半径比较、化学键、氧化还原反应计算等,难度中等,注意理解氧化还原反应中电子转移守恒.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰.在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为:Zn+2MnO2+H2O═ZnO+2MnO(OH).下列说法正确的是( )
| A、该电池的正极为锌 |
| B、该电池反应中二氧化锰起催化剂作用 |
| C、电池负极反应式为:Zn+2OH--2e-═ZnO+H2O |
| D、当 0.l mol Zn 完全溶解时,流经电解液的电子个数为1.204×l023 |
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
| A、加入合金的质量不可能为6.4 g |
| B、参加反应的硝酸的物质的量为0.1 mol |
| C、沉淀完全时消耗NaOH溶液的体积为150 mL |
| D、溶解合金时收集到NO气体标准状况下的体积为2.24 L |
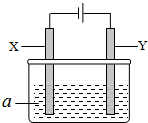 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: