题目内容
 在一定温度下有pH均为2的X、Y、Z三种不同的一元酸各5mL,分别加水稀释到5000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
在一定温度下有pH均为2的X、Y、Z三种不同的一元酸各5mL,分别加水稀释到5000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A、若X、Y、Z都是弱酸,则a的值一定小于5 |
| B、三种酸的原来的浓度大小为X>Y>Z |
| C、稀释后X溶液中水的电离程度最小 |
| D、完全中和原X、Y两溶液时,消耗同浓度NaOH的体积 V(X)>V(Y) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:由图可知,稀释相同的倍数,X的变化最大,Z的变化最小,说明Z加水稀释电离出更多氢离子,可知酸性X>Y>Z,溶液中氢离子浓度越大,酸性越强,对于一元强酸来说c(酸)=c(H+),但对于一元弱酸,c(酸)>c(H+),以此解答.
解答:
解:A.若X、Y、Z都是弱酸,加水稀释促进电离,导致溶液中c(H+)>10-5mol/L,则a的值一定小于5,故A正确;
B.三种酸的强弱不同,电离程度不同,pH相同时,酸的浓度肯定不同,故B错误;
C.稀释后X溶液的氢离子浓度最小,对水的抑制最小,则水的电离程度最大,故C错误;
D.酸Y较弱,pH相同时浓度较大,等体积时物质的量较大,则消耗NaOH的体积较大,故D错误.
故选A.
B.三种酸的强弱不同,电离程度不同,pH相同时,酸的浓度肯定不同,故B错误;
C.稀释后X溶液的氢离子浓度最小,对水的抑制最小,则水的电离程度最大,故C错误;
D.酸Y较弱,pH相同时浓度较大,等体积时物质的量较大,则消耗NaOH的体积较大,故D错误.
故选A.
点评:本题考查酸的稀释及图象,为高频考点,侧重学生的分析能力的考查,明确强酸在稀释时pH变化程度大及酸的浓度与氢离子的浓度的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
 恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
恒温下,a mol A和b mol B在如图所示活塞可自由滑动的容器中发生如下反应:A(g)+2B(g)?2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )| A、物质A、B的转化率之比为a:b |
| B、起始时刻和达平衡后容器中的压强比为(a+b):(a+b-n/2) |
| C、平衡时C的体积分数为n/(a+b-n/2) |
| D、当v正(A)=2v逆(B)时,可判定反应达到平衡 |
在一个V升的密闭容器中放入2L A气体和1L B气体,在一定条件下发生反应:3A(g)+B(g)?nC(g)+2D(g),达到平衡后,A的浓度减小,混合气体的平均分子量增大,则该反应方程式中n值是( )
| A、1 | B、2 | C、3 | D、4 |
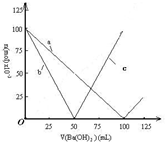 烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )
烧杯中盛有100mL 0.1mol/L的NaHSO4溶液,向其中逐滴滴加0.1mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图.下列说法正确的是( )| A、曲线a表示Ba2+的物质的量的变化 |
| B、曲线c表示OH-的物质的量的变化 |
| C、加入Ba(OH)2溶液50mL反应的离子方程式为Ba2++OH-+H++SO42-→BaSO4↓+H2O |
| D、加入Ba(OH)2溶液大于50mL后,反应的离子方程式为 OH-+H+→H2O |
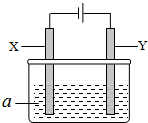 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: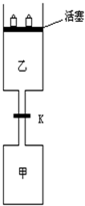 连通装置是化学研究的重要装置起始时,甲、乙体积均为1L,向甲、乙中均充入1.5mol A、3.5mol B,关闭阀门K.在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)?C(g)+2D(g)+200KJ.5分钟时甲达平衡,此时乙容器的体积为0.86L.请回答以下问题:
连通装置是化学研究的重要装置起始时,甲、乙体积均为1L,向甲、乙中均充入1.5mol A、3.5mol B,关闭阀门K.在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)?C(g)+2D(g)+200KJ.5分钟时甲达平衡,此时乙容器的体积为0.86L.请回答以下问题: