题目内容
2.下列有关化学用语的表示正确的是( )| A. | NH4Cl的电子式: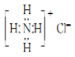 | |
| B. | 四氯化碳分子球棍模型: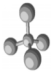 | |
| C. | 丙烯醛的结构简式:CH3CH2COH | |
| D. | 碳酸氢根离子的水解方程式:HCO3-+H2O?CO32-+H3O |
分析 A.漏写氯离子的电子;
B.四氯化碳中含有4个C-Cl键;
C.醛基应为-CHO;
D.HCO3-水解呈碱性.
解答 解:A.氯化铵为离子化合物,阴离子需要标出最外层电子,NH4Cl正确的电子式为: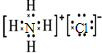 ,故A错误;
,故A错误;
B.四氯化碳中含有4个C-Cl键,球棍模型为 ,故B正确;
,故B正确;
C.丙醛的结构简式为CH3CH2CHO,故C错误;
D.碳酸氢根离子的水解方程式:HCO3-+H2O?H2CO3+OH-,故D错误.
故选B
点评 本题考查了常见化学用语的判断,为高频考点,题目难度中等,涉及电子式、球棍模型、有机物的结构简式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生规范答题的能力.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
10.常温下,Ka(CH3COOH)=Kb(NH3•H2O)=1.75×10-5,下列说法正确的是( )
| A. | 用0.1mol•L-1的盐酸滴定0.1mol•L-1的氨水时,可用酚酞作指示剂 | |
| B. | 0.2 mol•L-1的醋酸与0.1 mol•L-1的氢氧化钠溶液等体积混合,所得溶液中:c(CH3COO-)+c(OH-)=C(CH3COOH)+C(H+) | |
| C. | pH=3的醋酸与pH=11的氨水等体积混合,所得溶液中有水电离出的C(H+)=1×10-7 mol•L-1 | |
| D. | pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中C(NH3•H2O)>C(NH4+)>C(Cl-) |
13.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 50mL18mol•L-1浓硫酸与足量铜供热,转移电子数为0.9NA | |
| C. | 0.1molCl2通入含0.1molFeBr2溶液中,被氧化的溴离子数为0.2NA | |
| D. | 标准状况下,2.24LNO和足量O2反应生成物中含有NO2分子数为0.1NA |
10.某柔性燃料电池(以甲醇为燃料,酸性介质)结构示意如图.下列有关说法正确的是( )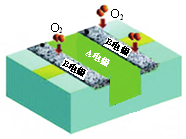

| A. | 电池工作时,电子由A电极经外电路流向B电极 | |
| B. | 电池工作时,减少的化学能完全转化为电能 | |
| C. | A电极发生的电极反应为:CH3OH-6e-+H2O═CO2+6H+ | |
| D. | B电极每消耗1 mol O2,电池中减少4 mol H+ |
17.下列说法正确的是( )
| A. | MgCO3可以除去MgCl2酸性溶液中的Fe3+ | |
| B. | 实验测得NaHSO3溶液的pH<7,说明则H2SO3是强酸 | |
| C. | 通过化学变化可以“点石成金”,即可将黏土转化成金单质 | |
| D. | 2.24LNO与1.12O2充分反应所得气体中原子数目一定为0.3×6.02×1023 |
14.下列有关物质的性质与用途具有对应关系的是( )
| A. | 碱石灰具有吸水性,可用于干燥氯气 | |
| B. | 甲醛能使蛋白质变性,可以用于食品防腐剂 | |
| C. | 炭具有强还原性,常用于冶炼钠、钾等金属 | |
| D. | 碳酸氢钠溶液具有弱碱性,可用于制胃酸中和剂 |
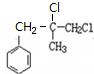
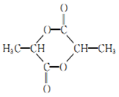
 .G的结构简式为
.G的结构简式为 .
. +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$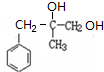 +2NaCl.
+2NaCl.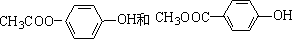 .
. 的合成路线:
的合成路线: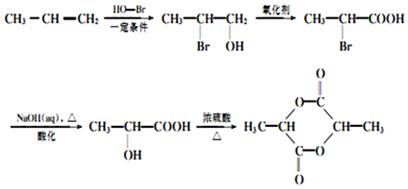 .
.