题目内容
10.某柔性燃料电池(以甲醇为燃料,酸性介质)结构示意如图.下列有关说法正确的是( )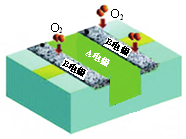
| A. | 电池工作时,电子由A电极经外电路流向B电极 | |
| B. | 电池工作时,减少的化学能完全转化为电能 | |
| C. | A电极发生的电极反应为:CH3OH-6e-+H2O═CO2+6H+ | |
| D. | B电极每消耗1 mol O2,电池中减少4 mol H+ |
分析 A、B极通入氧气,所以B是正极发生还原反应;
B、减少的化学能有部分转化为热能;
C、A电极甲醇发生氧化反应;
D、B电极的电极反应式为:O2+4e-+4H+=2H2O,而负极同时产生4 mol H+,所以整个电池氢离子的浓度不减少.
解答 解:A、B极通入氧气,所以B是正极发生还原反应,所以电子由A电极经外电路流向B电极,故A正确;
B、减少的化学能有部分转化为热能,未完全转化为电能,故B错误;
C、A电极甲醇发生氧化反应,电极反应式为:CH3OH-6e-+H2O═CO2+6H+,故C正确;
D、B电极的电极反应式为:O2+4e-+4H+=2H2O,而负极同时产生4 mol H+,所以整个电池氢离子的浓度不减少,故D错误;
故选AC.
点评 本题考查了化学电源新型电池,根据正负极上得失电子及电极反应式来分析解答,并结合转移电子相等进行计算,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,难度中等.

练习册系列答案
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
18.下列各组离子在指定溶液中一定不能大量共存的是( )
| A. | 含有大量Ba2+ 的溶液:Na+、SO42-、NH4+ | |
| B. | 0.1mol/LNa2CO3溶液:K+、AlO2-、Cl-、NO3- | |
| C. | 25°C时pH<7的溶液:K+、Cu2+、Fe3+、NO3- | |
| D. | 遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- |
1.下列实验中,所选装置合理的是( )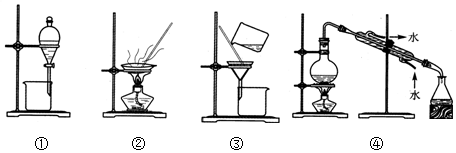

| A. | 装置①用于分离苯和水 | |
| B. | 装置②用于分离乙醇中的水 | |
| C. | 装置③用于分离FeCl3和Fe(SCN)3 | |
| D. | 装置④用于分离氯化钠和氯化铵固体 |
18.下列变化的实质相似的是( )
| A. | 浓硫酸与浓盐酸在空气中敞口放置时浓度均减小 | |
| B. | 金属导电与电解质溶液导电 | |
| C. | 在净水过程中分别使用明矾和漂白粉 | |
| D. | 工业上制取金属铁和金属铜 |
5.用下列实验装置进行有关实验,能达到实验目的是( )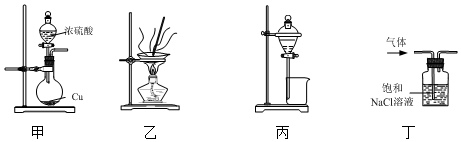

| A. | 用装置甲制取少量SO2 | |
| B. | 用装置乙蒸发FeCl3溶液制取FeCl3晶体 | |
| C. | 用装置丙分离CH3COOH和CH3COOCH2CH3的混合液 | |
| D. | 用装置丁除去Cl2中混有的少量HCl气体 |
15.短周期主族元素X、Y、Z、W的原子序数依次递增,四种原子最外层电子数之和为18,X与Z同主族,Y原子的最外层电子数等于周期数,W的单质在常温下为气体.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) | |
| B. | 简单氢化物的稳定性:W>Z | |
| C. | 元素X的单质只存在两种同素异形体 | |
| D. | X、Y、W最高价氧化物对应的水化物两两之间能发生反应 |
2.下列有关化学用语的表示正确的是( )
| A. | NH4Cl的电子式: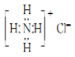 | |
| B. | 四氯化碳分子球棍模型: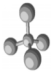 | |
| C. | 丙烯醛的结构简式:CH3CH2COH | |
| D. | 碳酸氢根离子的水解方程式:HCO3-+H2O?CO32-+H3O |
19.某有机物A的结构简式如图所示,下列有关叙述中正确的是( )
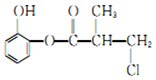
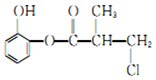
| A. | 有机物A与浓硫酸混合加热,可以发生消去反应 | |
| B. | 1 molA 与足量的H2发生加成反应,最多可以消耗4mol H2 | |
| C. | 1 molA 与足量的NaOH 溶液充分反应,最多可以消耗4 mol NaOH | |
| D. | 有机物A 的同分异构体中能在稀硫酸存在下水解生成二苯酚的有6 种 |
11.下列反应既属于氧化还原反应,又属于放热反应的是( )
| A. | 灼热的碳与二氧化碳的反应 | |
| B. | 盐酸与烧碱溶液的反应 | |
| C. | 乙醇在空气中的燃烧 | |
| D. | 氢氧化钡晶体与氯化铵晶体在常温下的反应 |