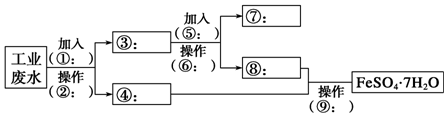
题目内容
3.室温时,若pH=5的硫酸稀释10倍,则[H+]:[SO42-]=2:1.若将稀释后的溶液再稀释100倍,则[H+]:[SO42-]=20:1.分析 稀释过程中硫酸的物质的量不变,当溶液接近中性时要考虑水的电离;由硫酸溶液pH=5,计算原溶液中c(H+),原溶液中c(SO42-)=$\frac{1}{2}$c(H+),稀释1000倍,此时溶液接近中性,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而稀释过程中硫酸根的物质的量不变,计算稀释后溶液中硫酸根的物质的量浓度,据此计算解答;
解答 解:pH为5的溶液中氢离子浓度为:c(H+)=1×10-5mol/L,硫酸根离子的浓度为:c(SO42-)=$\frac{1}{2}$c(H+)=$\frac{1}{2}$×1×10-5mol/L=5×10-6mol/L;
将pH=5的H2SO4稀释10倍,溶液中的氢离子和硫酸根离子同等倍数的减小,所以两者之比为:2:1,稀释过程中硫酸的物质的量不变,当溶液接近中性时要考虑水的电离,溶液再稀释100倍,相当于原溶液稀释1000倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=5×10-6mol/L×$\frac{1}{1000}$=5×10-9mol/L,
所以稀释后溶液中SO42-离子浓度与H+离子浓度的比值约为:5×10-9mol/L:1×10-7mol/L=1:20,
所以若将稀释后的溶液再稀释100倍后,溶液中的H+与SO42-浓度的比值约为20:1,
故答案为:2:1;20:1.
点评 本题考查了弱电解质的电离、pH的计算等知识点,注意当酸无限稀释时溶液中氢离子浓度要考虑水的电离,酸性溶液不能变为中性或碱性,为易错点,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列有关化学用语的表示正确的是( )
| A. | NH4Cl的电子式: | |
| B. | 四氯化碳分子球棍模型: | |
| C. | 丙烯醛的结构简式:CH3CH2COH | |
| D. | 碳酸氢根离子的水解方程式:HCO3-+H2O?CO32-+H3O |
3.下列说法正确的是( )
| A. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| B. | 在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 | |
| C. | 11.2 g Fe在高温下与足量水蒸气反应,生成的H2分子数目为0.3×6.02×1023 | |
| D. | 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出的氢气多,说明酸性HB>HA |
11.下列反应既属于氧化还原反应,又属于放热反应的是( )
| A. | 灼热的碳与二氧化碳的反应 | |
| B. | 盐酸与烧碱溶液的反应 | |
| C. | 乙醇在空气中的燃烧 | |
| D. | 氢氧化钡晶体与氯化铵晶体在常温下的反应 |
18.下列除去杂质的操作中不正确的是( )
| A. | CuO中混有Al2O3:加入过量烧碱溶液充分反应后过滤 | |
| B. | FeCl2溶液中混有CuCl2:加入过量铁粉充分反应后过滤 | |
| C. | Na2CO3固体中混有少量NaHCO3:加入过量NaOH溶液,反应后加热蒸干 | |
| D. | 乙烷中混有乙烯:将混合气体通过盛溴水的洗气瓶 |
8.下列反应中属于氧化还原反应,但水既不做氧化剂,又不做还原剂的是( )
| A. | ICl+H2O=HCl+HIO | B. | 2K+2H2O=2KOH+H2↑ | ||
| C. | 2F2+2H2O=4HF+O2 | D. | 2Na2O2+2H2O=4NaOH+O2 |
15.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
13.利用如图所示装置进行下列实验,装置正确并能达到实验目的是( )
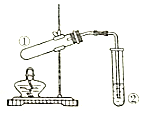

| 选项 | ①中试剂 | ②中溶液 | 实验目的 |
| A | 二氧化锰(s),浓盐酸 | 饱和食盐水 | 制取氯气 |
| B | Na2SO3(s),70%H2SO4 | 酸性高锰酸钾 | 验证SO2的还原性 |
| C | Na2CO3(s)或NaHCO3(s) | 澄清石灰水 | 鉴别Na2CO3和NaHCO3 |
| D | 乙醇、乙酸、浓硫酸 | 饱和碳酸钠 | 制取乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |