题目内容
10.常温下,Ka(CH3COOH)=Kb(NH3•H2O)=1.75×10-5,下列说法正确的是( )| A. | 用0.1mol•L-1的盐酸滴定0.1mol•L-1的氨水时,可用酚酞作指示剂 | |
| B. | 0.2 mol•L-1的醋酸与0.1 mol•L-1的氢氧化钠溶液等体积混合,所得溶液中:c(CH3COO-)+c(OH-)=C(CH3COOH)+C(H+) | |
| C. | pH=3的醋酸与pH=11的氨水等体积混合,所得溶液中有水电离出的C(H+)=1×10-7 mol•L-1 | |
| D. | pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中C(NH3•H2O)>C(NH4+)>C(Cl-) |
分析 A.盐酸和一水合氨反应生成氯化铵,铵根离子水解溶液显酸性,选择酸性溶液中指示剂变色的指示剂;
B.0.2 mol•L-1的醋酸与0.1 mol•L-1的氢氧化钠溶液等体积混合,得到等浓度的醋酸钠和醋酸混合溶液,结合溶液中电荷守恒和物料守恒计算分析判断;
C.pH=3的醋酸与pH=11的氨水等体积混合恰好完全反应生成醋酸铵溶液,常温下,Ka(CH3COOH)=Kb(NH3•H2O)=1.75×10-5分析;
D.pH=3的盐酸与pH=11的氨水等体积混合,一水合氨又电离出氢氧根离子和铵根离子.
解答 解:A.用0.1mol•L-1的盐酸滴定0.1mol•L-1的氨水时,恰好反应生成氯化铵,溶液显酸性,酚酞变色范围为8-10碱性溶液中变色,不可用酚酞作指示剂,应选择变色范围3.1-4.4变色的甲基橙做指示剂,故A错误;
B.0.2 mol•L-1的醋酸与0.1 mol•L-1的氢氧化钠溶液等体积混合,得到等浓度的醋酸钠和醋酸混合溶液,溶液中电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+),物料守恒2c(Na+)=c(CH3COO-)+c(CH3COOH),得到c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),故B错误;
C.常温下,Ka(CH3COOH)=Kb(NH3•H2O)=1.75×10-5,醋酸根离子和铵根离子都发生水解,促进水的电离,二者水解程度相近,溶液pH=7,所得溶液中有水电离出的C(H+)>1×10-7 mol•L-1 ,故C错误;
D.pH=3的盐酸溶液中氢离子浓度和氯离子浓度为10-3mol/L,pH=11的氨水溶液中c(OH-)=c(NH4+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,等体积混合,一水合氨又电离出氢氧根离子和铵根离子,原氨水溶液浓度大于盐酸,所得溶液为氯化铵和一水合氨溶液,溶液中c(NH3•H2O)>c(NH4+)>c(Cl-),故D正确;
故选D.
点评 本题考查学生电离平衡及影响因素知识,注意知识的归纳和整理是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案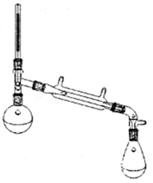 环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯:
环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯: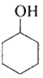 $→_{△}^{H_{2}SO_{4}}$
$→_{△}^{H_{2}SO_{4}}$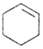 +H2O
+H2O环己醇、环己烯的部分物理性质见表:
| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己烯 | 83(70.8)* | 0.8085 | 不溶于水 |
Ⅰ:制备环己烯粗品.实验中将环己醇与浓硫酸混合加入烧瓶中,按图所示装置,油浴加热,蒸馏约1h,收集馏分,得到主要含环己烯和水的混合物.
Ⅱ:环己烯的提纯.主要操作有abcde;
a.向馏出液中加入精盐至饱和;
b.加入3~4mL5%Na2CO3溶液;
c.静置,分液;
d.加入无水CaCl2固体;
e.蒸馏
回答下列问题:
(1)油浴加热过程中,温度控制在90℃以下,蒸馏稳定不宜过高的原因是减少未反应的环己醇蒸出.
(2)蒸馏不能彻底分离环己烯和水的原因是环己烯和水形成具有固定组成的混合物一起被蒸发.
(3)加入精盐至饱和的目的是增加水层的密度,有利于分层.
(4)加入3~4mL5%Na2CO3溶液的作用是中和产品中混有的微量的酸
(5)加入无水CaCl2固体的作用是除去有机物中少量的水
(6)利用核磁共振氢谱可以鉴定制备的产物是否为环己烯,环己烯分子中有 种不同环境的氢原子3.
| A. | 不慎将酸液溅到眼中,应立即用大量水冲洗,边洗边眨眼睛 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 洒在桌面上的酒精燃烧,立即用湿抹布盖灭 | |
| D. | 进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| A. | 含有大量Ba2+ 的溶液:Na+、SO42-、NH4+ | |
| B. | 0.1mol/LNa2CO3溶液:K+、AlO2-、Cl-、NO3- | |
| C. | 25°C时pH<7的溶液:K+、Cu2+、Fe3+、NO3- | |
| D. | 遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- |
| 选项 | 实验 | 现象 | 结论 |
| A | 将苯滴加到溴水中 | 溴水褪色 | 苯和溴发生了取代反应 |
| B | 将CO2通入CaCl2溶液中 | 溶液中有白色沉淀出现 | 生成的CaCO3难溶于水 |
| C | 用NO2气体做喷泉实验 | 液体充满烧瓶 | NO2完全溶于水 |
| D | 向氯化铵溶液中投入一铝片 | 铝片上产生大量气泡 | 氯化铵溶液显酸性,产生了 |
| A. | A | B. | B | C. | C | D. | D |
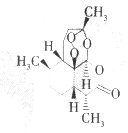 中国中医研究院终身研究员兼首席研究员屠呦呦于1971年首先从黄花蒿中发现抗疟有效提取物,1972年分离出新型结构的抗疟有效成分青蒿素,拯救了数千万人的生命.青蒿素的分子结构如图.下列说怯错误的是( )
中国中医研究院终身研究员兼首席研究员屠呦呦于1971年首先从黄花蒿中发现抗疟有效提取物,1972年分离出新型结构的抗疟有效成分青蒿素,拯救了数千万人的生命.青蒿素的分子结构如图.下列说怯错误的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素是芳香族化合物 | |
| C. | 青蒿素分子中含有过氧链、酯基和醚键 | |
| D. | 青蒿素不能发生加成反应 |
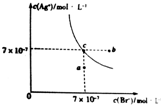 已知t℃时AgCl的Ksp=4×10-10,在此温下AgBr在水中的沉淀溶解平衡曲线如图所示.下列有关说法正确的是( )
已知t℃时AgCl的Ksp=4×10-10,在此温下AgBr在水中的沉淀溶解平衡曲线如图所示.下列有关说法正确的是( )| A. | t℃时,图中a点到c点所示溶液变化状态可加入AgBr固体 | |
| B. | 在AgBr饱和溶液中加入NaBr固体,可使溶液状态由c点到b点 | |
| C. | 在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)平衡常数K=28.6 | |
| D. | 在t℃时,向含Br-、Cl-的溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c(B{r}^{-})}{c(C{l}^{-})}$为1.225×10-3 |
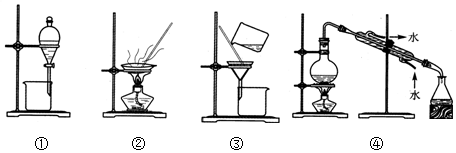
| A. | 装置①用于分离苯和水 | |
| B. | 装置②用于分离乙醇中的水 | |
| C. | 装置③用于分离FeCl3和Fe(SCN)3 | |
| D. | 装置④用于分离氯化钠和氯化铵固体 |
| A. | NH4Cl的电子式: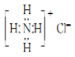 | |
| B. | 四氯化碳分子球棍模型: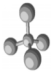 | |
| C. | 丙烯醛的结构简式:CH3CH2COH | |
| D. | 碳酸氢根离子的水解方程式:HCO3-+H2O?CO32-+H3O |